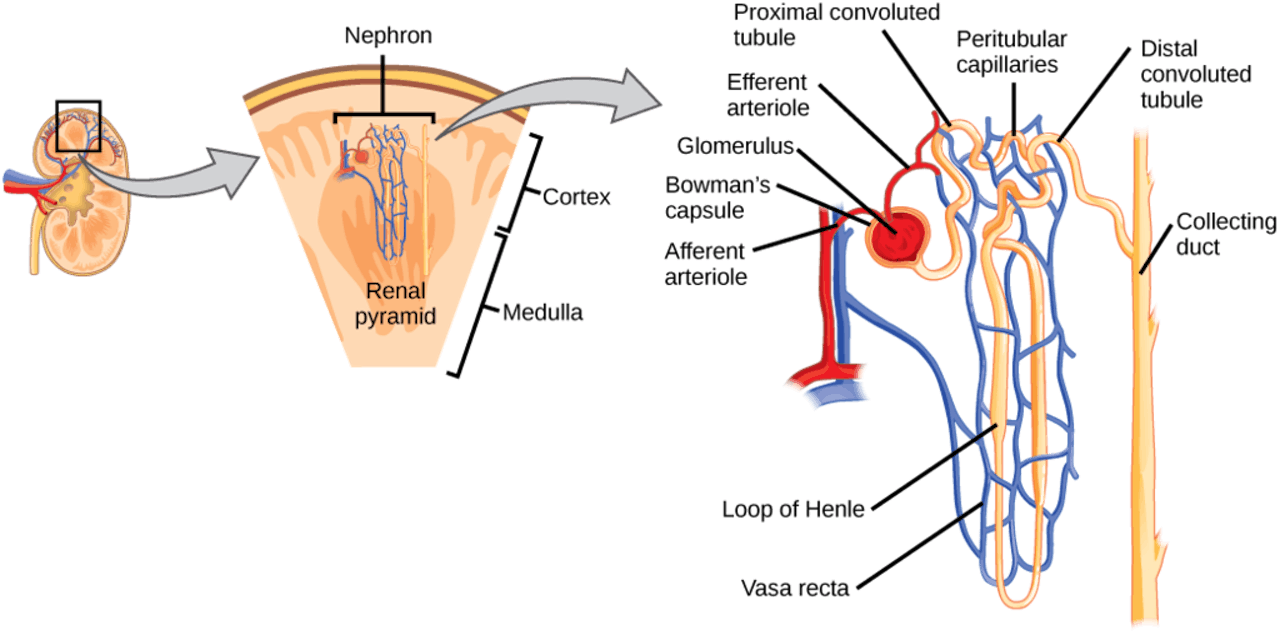
Een 3D-printer gebruikt meestal plastic of metaal. Maar wist je dat je dit ook met levende cellen kan doen? Dat heet bioprinten. Het maken van een volledige nier is nog een toekomstdroom, maar in Maastricht printen ze wel al nierweefsel in 3D.
Het maken een implanteerbare kunstnier is een grote puzzel waaraan veel onderzoek wordt gedaan. Carlos Mota, onderzoeker aan de afdeling complexe weefselregeneratie van de Universiteit Maastricht, werkt aan een stukje van die puzzel: het 3D-printen van levende niercellen, oftewel het bioprinten van nierweefsel.
Organen printen in niet nieuw. In 2011 demonstreerde Anthony Atala in een TEDtalk dat het mogelijk is om een volledig 3D-model van een nier te printen. “Een mooie demonstratie van waar de wetenschap naartoe werkt, maar een functioneel orgaan was het nog niet”, vertelt Mota. Aan dit model ontbrak namelijk de volledige interne structuur: alle netwerken van bloedvaten en buisjes die een nier functioneel maken en urine produceren.
Stukje nier
Mota werkt dan ook nog niet aan een volledige nier. Zijn doel is eerst om een functioneel stukje van dit orgaan te maken: de nefron. Die zijn belangrijk: als ze niet goed werken, worden er niet voldoende afvalstoffen uit het bloed gezuiverd en vergiftigt het lichaam zichzelf. Dit is wat er misgaat bij nierziekten. Er zijn te weinig nefronen of ze werken niet goed, waardoor het bloed kunstmatig gezuiverd moet worden om een patiënt in leven te kunnen houden.
In zijn bioprinter stopt Mota stamcellen in verschillende stadia van ontwikkeling. “Deze cellen zijn nog niet volgroeid”, legt hij uit. “Ze kunnen allerlei verschillende niercellen worden.” Aan de cellen voegt hij soort gel toe die voornamelijk uit water bestaat. “De gel bootst de structuur na die niercellen in het lichaam tegenkomen, en dat stimuleert ze om te groeien en om de juiste vorm aan te nemen.”
Waarom is het eigenlijk nodig om te bioprinten? Meerdere onderzoeksgroepen zijn al zo ver dat ze mininiertjes (organoïden) kunnen maken vanuit stamcellen in het laboratorium. “Het probleem daarmee is dat de nefronen niet goed ontwikkelen”, legt Mota uit. “We zien bijvoorbeeld wel wat doorbloeding, maar het filtraat (de urine) gaat nergens naartoe.” Nefronen zijn complex. Ze bestaan uit filters, buisjes en een ingewikkeld netwerk van bloedvaten. Dit moet allemaal goed samenwerken om de urine uiteindelijk af te voeren. Mota: “Het bioprinten van nierweefsel helpt ons om al die elementen op de juiste plek te brengen. We hopen dat de stamcellen zich daardoor beter ontwikkelen.”
Langzaam proces
Mota geeft de stamcellen die hij wil bioprinten groeifactoren om ze te stimuleren om uit te groeien tot nefroncellen. “We zijn bezig om dat proces te verfijnen, zodat zoveel mogelijk van die stamcellen ook daadwerkelijk niercellen worden. Daarnaast werken we aan het printen van de buisjes.” Op dit moment werkt hij eerst met niercellen uit muizen, om de manier van bioprinten goed in de vingers te krijgen.
Het laboratoriumwerk gaat langzaam, en het zal daarom nog jaren duren voordat Mota een functionele nefron kan maken. En als dat eenmaal zover is, moet het nog getest worden buiten het laboratorium: door het te implanteren in de nier van een muis bijvoorbeeld. Een compleet geprinte kunstnier is dus nog een toekomstdroom. Bovendien zijn Mota en zijn collega een van de eersten in Europa die hieraan werken. Toch blijft hij gemotiveerd. “De nier is een geweldig orgaan en zo complex, dat stimuleert mijn nieuwsgierigheid en creativiteit. Mijn achtergrond is in de bio-engineering en ik heb al veel gewerkt aan bioprinten. Ik vind het gaaf om deze kennis nu te gebruiken voor dit onderzoek.”