Al in de eerste helft van de vorige eeuw, sinds de ontdekking van penicilline door Alexander Flemming in 1928, is men op zoek naar nieuwe antibiotica. Dit gebeurde vooral door het kweken van bacteriën en schimmels en vervolgens de kweekvloeistof of voedingsbodem te testen op antimicrobiële activiteit. Deze aanpak heeft geleid tot de ontdekking van honderden moleculen waarvan er slechts enkelen geschikt waren voor de behandeling van mensen. Nog steeds wordt deze methode gebruikt om nieuwe antibiotica te zoeken. Het grote nadeel is dat er vooral bekende stoffen worden (her)ontdekt.
Het zoeken naar nieuwe antibiotica moet dus slimmer. Maar hoe dan? Het ideale antibioticum moet effectief zijn in het doden van de infectieveroorzakende bacterie in het lichaam en zo min mogelijk bijwerkingen geven. Dit betekent dat er een aantal belangrijke eisen zijn voor het aangrijpingspunt waarop het antibioticum inwerkt. Het aangrijpingspunt moet essentieel en uniek voor de bacterie zijn en het liefst gemakkelijk bereikbaar.
Kies een slim aangrijpingspunt
Vaak zijn eiwitten die belangrijke functies voor bacteriën uitvoeren aangrijpingspunten van antibiotica, echter er is ook een voorbeeld van een aangrijpingspunt dat niet een eiwit is en dit heeft belangrijke voordelen. Door de opkomst van de resistente bacteriën is men er van bewust geraakt dat, om snelle resistentie opbouw te voorkomen, er aanvullende eisen nodig zijn voor het ideale antibioticum. Deze eisen zijn: het antibioticum moet het liefst meerdere vergelijkbare aangrijpingspunten in één keer aanpakken, of het aangrijpingspunt is géén eiwit.
In het eerste geval is resistentieopbouw veel moeilijker omdat er meerdere veranderingen (mutaties) moeten optreden voordat er resistentie optreedt, zoals bij de penicilline-achtige antibiotica. Deze grijpen in op meerdere (essentiële) eiwitten die allemaal betrokken zijn bij de opbouw van de unieke bacteriële celwand. In het tweede geval van een aangrijpingspunt dat geen eiwit is zijn er vaak meerdere eiwitten betrokken bij de synthese ervan en is een verandering van het aangrijpingspunt vaak niet eens mogelijk zonder desastreuze gevolgen voor de bacterie zelf.
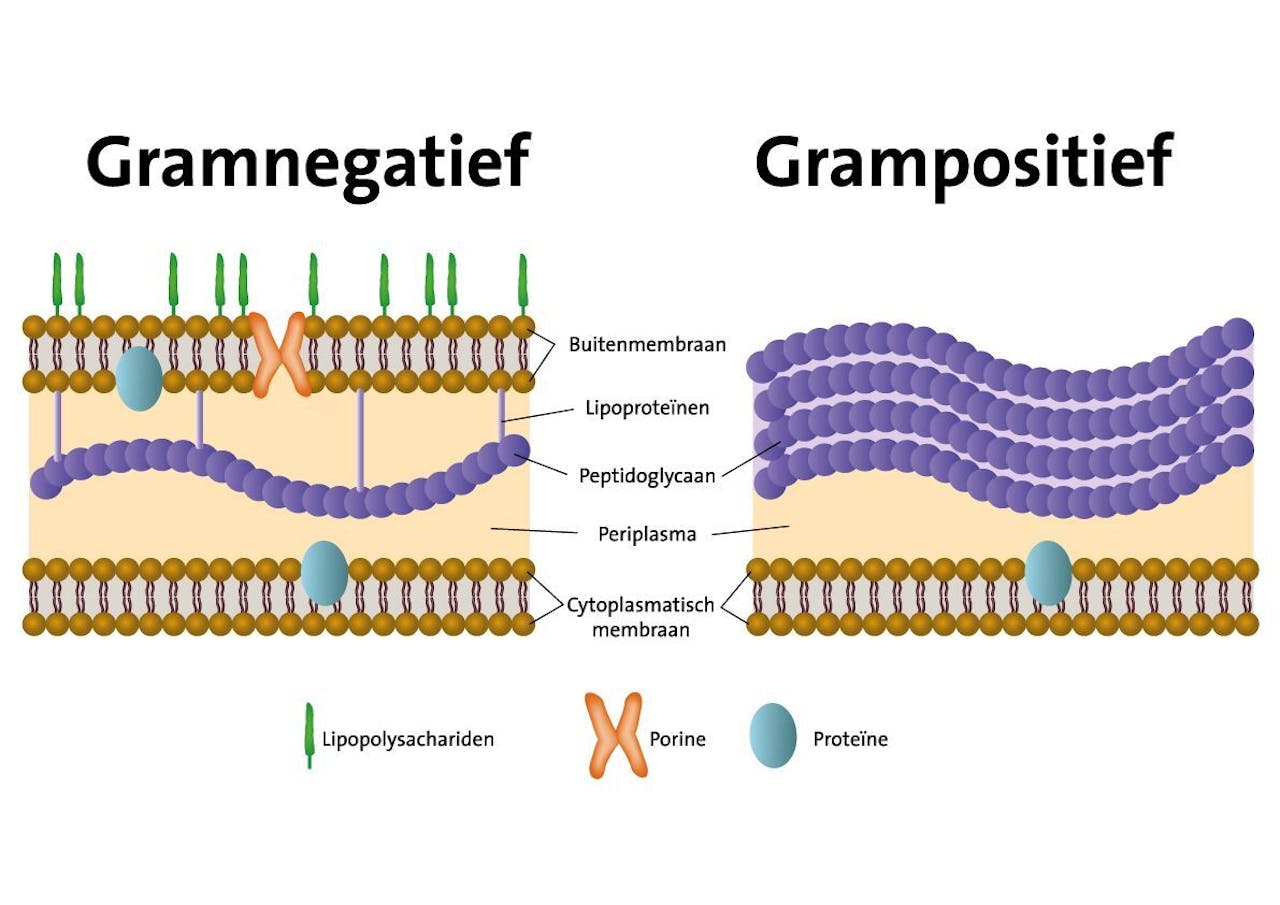
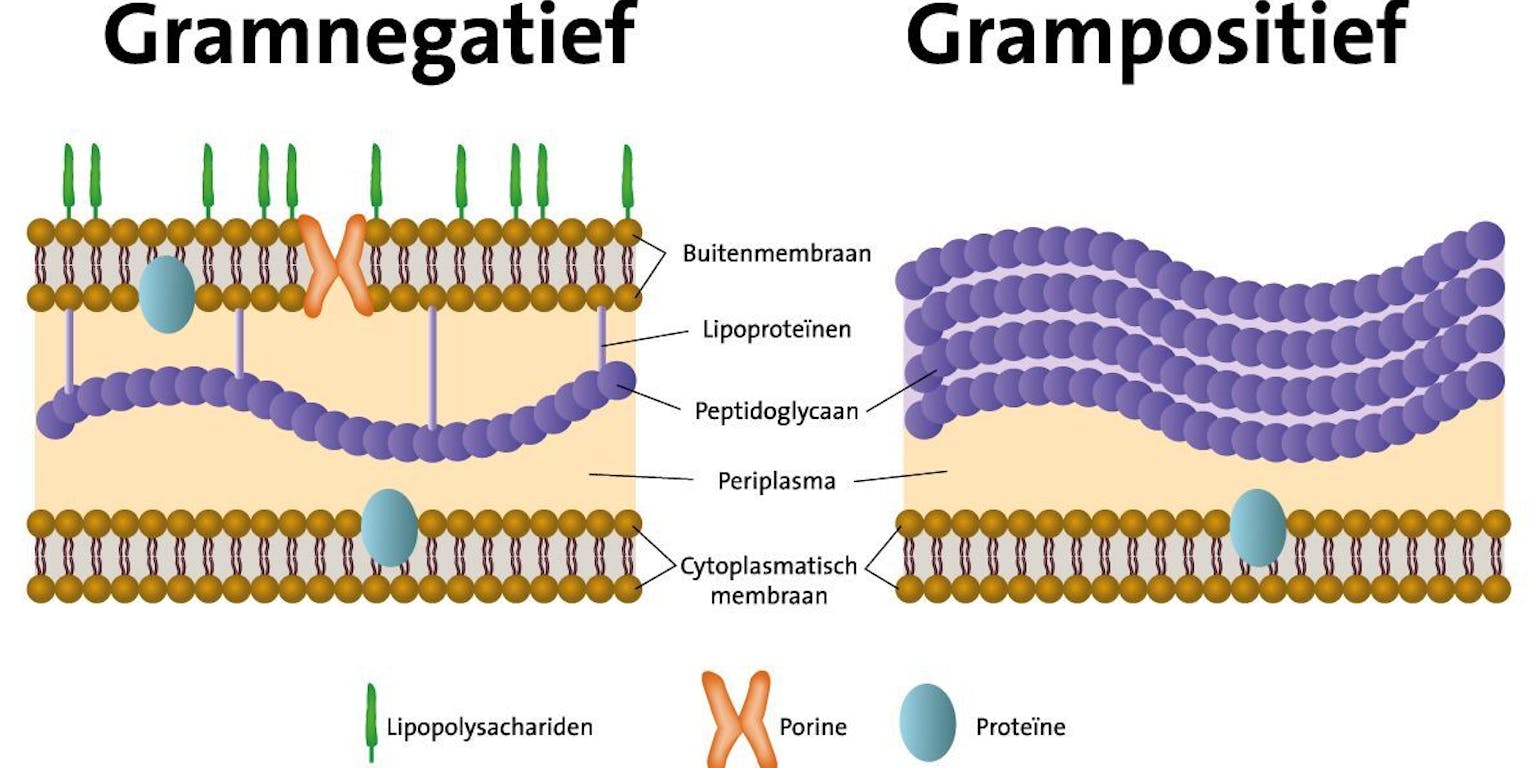
Gramnegatieve bacteriën (linkerdeel) hebben een extra buitenmembraan naast de celwand van peptidoglycaan (paarse bolletjes), waardoor veel geneesmiddelen niet in de bacterie kunnen doordringen. Hierdoor zijn gramnegatieve bacteriën in het algemeen minder gevoelig voor antibiotica zoals penicilline dan grampositieve bacteriën (rechterdeel), en zijn lastiger te bestrijden.
Biowetenschappen en Maatschappij, DreamstimeZo speelt de drager van de celwandbouwstenen Lipide II, een vetachtig molecuul, een sleutelrol binnen de bacteriële celwandsynthese. De bouwsteendrager Lipide II is een mooi voorbeeld om het slim zoeken naar nieuwe antibiotica te illustreren. Naast de grote kans op herontdekking van bekende antibiotica, had de traditionele manier van zoeken nog een nadeel: veel interessantere actieve stoffen, die om een of andere reden minder werden geproduceerd, werden door de activiteit van bekende antibiotica overschaduwd en gemist.
Het nadeel van herontdekken is eigenlijk vrij gemakkelijk te ondervangen door de test iets anders uit te voeren: naast de ‘normale’ test op antimicrobiële activiteit wordt ook de activiteit in aanwezigheid van het toegevoegde aangrijpingspunt zoals Lipide II getest. Wanneer er een nieuw antibioticum aanwezig is dat aangrijpt op Lipide II dan zal de groei niet meer geremd worden omdat Lipide II het antibioticum wegvangt voordat het zijn antimicrobiële werking kan doen. Door deze wijze van screenen te gebruiken met een volledig nieuw aangrijpingspunt is het vrijwel uitgesloten dat er bekende antibiotica worden gevonden.
Vissen tussen bekende antibiotica
Om het tweede nadeel te ondervangen, zijn de ‘geen-eiwit’-aangrijpingspunten’ zoals Lipide II eveneens uitermate geschikt. Ze kunnen worden gebruikt om specifiek te vissen naar nieuwe antibiotica, zelfs in kweekvloeistof die grote hoeveelheden andere bekende antibiotica bevat. Dit kan door Lipide II chemisch te koppelen aan een dragermateriaal, meestal kleine bolletjes, waarmee de stoffen die aan Lipide II binden er uitgehaald worden.
Met deze methode kan ook direct een hoge zuiverheid van de nieuwe stof worden behaald waardoor vrij snel de identiteit van de moleculen bekend is. Deze methode werkt zeer goed voor ‘geen-eiwit’-aangrijpingspunten die makkelijk bereikbaar zijn, zoals Lipide II. Dit komt omdat de celwandsynthese de enige bacteriële machinerie is die grotendeels buiten de celmembraan actief is.
Voor aangrijpingspunten die in de cel hun functie uitoefenen bleek deze methode minder geschikt, omdat achteraf vaak blijkt dat de gevonden stoffen niet door de celmembraan van bacteriën heen kunnen. Een elegante oplossing hiervoor is de ontwikkeling van slimme screeningsmethoden die gebruik maken van hele cellen. Dit kan op verschillende manieren. Bijvoorbeeld door gebruik te maken van een bacteriemutant die meer gevoelig zal zijn voor antibiotica die ingrijpen op één bepaalde biosyntheseroute. Door allerlei extracten te testen op deze mutant en de activiteiten te vergelijken met het wildtype, zullen de extracten met antibiotica die op de gekozen biosyntheseroute werken gemakkelijk te identificeren zijn door het verschil in groeiremmend effect.
Deze aanpak is een aantal jaren geleden succesvol toegepast door het farmaceutische bedrijf Merck dat een nieuw antibioticum (platensimycine) identificeerde dat inwerkt op de vetzuursynthese van grampositieve bacteriën (zoals de beruchte MRSA). Helaas bleek later dat de vetzuursynthese van deze bacteriën helemaal niet zo’n goed aangrijpingspunt is: wanneer de bacteriën in aanwezigheid van bloedplasma groeien, halen ze de vetzuren gewoon uit het plasma. Dit bewijst wederom de noodzaak van de keuze van een goed aangrijpingspunt.