Twee van de vier coronavaccins die in Nederland worden gebruikt, zijn zogeheten RNA-vaccins. Wat is een RNA-vaccin en wat kunnen we ervan verwachten? Diverse experts geven antwoord op zeven vragen.
Twee vaccins die in Nederland worden gebruikt, van Pfizer/BioNTech en Moderna, werken met een techniek die RNA gebruikt. Omdat dit een relatief nieuwe techniek is, leven er veel vragen in de samenleving. NEMO Kennislink sprak met meerdere experts over een aantal prangende vragen, zoals de manier waarop deze technologie werkt, hoe veilig het is en hoe lang je beschermd bent door het vaccin.
1. Wat is een RNA-vaccin en waarin verschilt het van een ‘klassiek’ vaccin?
Klassieke vaccins bestaan uit dode of verzwakte micro-organismen, of uit eiwitten van die micro-organismen. Het RNA-vaccin tegen het coronavirus bevat geen virus, maar wel instructies (code) voor het maken van spijkereiwitten, de uitsteeksels op de buitenkant van het coronavirus, in de vorm van RNA. Met die code maken lichaamscellen zelf corona-eiwitten. Het immuunsysteem herkent die eiwitten als deel van een indringer, en gaat vervolgens in de aanval. Zo maakt het antistoffen aan.
Voor klassieke vaccins kweken wetenschappers virussen, of stukjes daarvan, in levende cellen. Dat kunnen menselijke cellen of dierlijke cellen zijn, of zelfs bevruchte kippeneieren. Die methode is tijdsintensief en zulke biologische fabriekjes hebben daarnaast ook last van biologische variatie: geen twee cellen of twee eieren zijn precies hetzelfde, waardoor de virusproductie niet altijd stabiel is. Ook moeten ze precies de juiste hoeveelheid voeding en zuurstof krijgen en in een steriele omgeving gehouden worden om bacterie- en schimmelinfecties te voorkomen.
RNA-vaccins komen tot stand in een reageerbuisje, zonder dat er cellen, eieren of ander levend materiaal bij komt kijken. Daarmee omzeilen wetenschappers problemen met biologische variatie en infecties. “Het startmateriaal voor het RNA-vaccin is een stukje DNA”, vertelt Anke Huckriede, Hoogleraar Vaccinologie aan het Universitair Medisch Centrum Groningen (UMCG). Dat stukje DNA is in het laboratorium gemaakt. Het bevat instructies voor het maken van het spijkereiwit van het coronavirus, het deel van het virus dat ons immuunsysteem herkent. Om dat spijkereiwit te bouwen, moet de code omgezet worden naar RNA. Met een enzym zetten wetenschappers het DNA om naar RNA, op dezelfde manier zoals het in het lichaam gebeurt.
Een RNA-molecuul op zichzelf is niet geschikt als vaccin, omdat ons lichaam zo’n molecuul buiten de cel binnen enkele minuten afbreekt. “Het is dus een uitdaging om het lang genoeg in het lichaam te houden”, zegt Huckriede. “Zeker omdat het zich niet vermenigvuldigt in de cellen zoals een virus dat doet”. Daarom verpakken farmaceuten het genetisch materiaal in kleine, beschermende vetbolletjes.
2. Deze vaccins zijn de eerste in hun soort en ook nog eens snel ontwikkeld. Zijn ze wel veilig?
RNA-vaccins zijn niet geheel nieuw. Het idee is zelfs al zo’n vijftien jaar oud. Sindsdien hebben wetenschappers de technologie verder ontwikkeld. Ze ontdekten bijvoorbeeld hoe ze het RNA het best konden verpakken, in vetbolletjes. “Van dat voorwerk plukken we nu de vruchten”, zegt Patricia Bruijning-Verhagen, kinderarts-epidemioloog bij het Universitair Medisch Centrum Utrecht (UMCU).
Ook waren wetenschappers en farmaceuten al bekend met coronavirussen. Door eerder onderzoek naar coronavirussen, zoals SARS en MERS, weten onderzoekers hoe zo’n coronavirus in elkaar steekt. Ze leerden dat coronavirussen hun spijkereiwitten nodig hebben om cellen te infecteren, wat zulke eiwitten uitstekende kandidaten maakt voor een vaccin. In combinatie met data van de eerste coronapatiënten, die inderdaad antilichamen tegen de spijkereiwitten maakten, zaten de onderzoekers al snel op het juiste spoor.
Een grote tijdwinst behaalden farmaceuten door hun proeven efficiënter te stroomlijnen. Die voerden ze deels tegelijkertijd uit, in plaats van na elkaar. “Normaal gebeurt dat niet, omdat bedrijven enorm veel geld moeten investeren in iedere stap”, vertelt Bruijning-Verhagen. “Als bedrijf wil je niet het risico lopen om die investering te verliezen als blijkt dat de vorige stap niet succesvol was”. Door de grote financiële bijdragen van overheden en stichtingen vielen die financiële risico’s weg.
Daarnaast werkten de farmaceuten tijdens het gehele proces nauw samen met het Europees Geneesmiddelenbureau (EMA), het bureau dat over goedkeuring van vaccins gaat. Voorheen ontwikkelden farmaceuten een nieuw vaccin, voerden experimenten uit en doorliepen alle klinische onderzoeken. Pas daarna verwerkten ze alle informatie in een dossier dat het EMA vervolgens doorspitte. Nu hanteert het EMA tussentijdse evaluaties, waardoor hun werk parallel loopt aan het onderzoek. Zonder stappen over te slaan, winnen ze zo al snel een jaar tijd.
Hoe zit het dan met bijwerkingen? Toen in december 2020 de eerste prikken werden gezet, vertoonden twee Britse zorgmedewerkers een allergische reactie na vaccinatie met het Pfizer/BioNTech-vaccin. Beide zorgmedewerkers hadden een geschiedenis van ernstige allergische reacties en maakten het weer goed na behandeling. Een dergelijke anafylactische reactie is uiterst zeldzaam.
Een dergelijke bijwerking werd niet eerder gezien bij de klinische studie met meer dan 40 duizend mensen. Wel gaf de laatste versie van het vaccin in enkele gevallen andere, milde bijwerkingen. Enkele jonge deelnemers (18 tot 55 jaar) kregen last van hoofdpijn, moeheid, kou, spierpijn en gewrichtspijn. Oudere deelnemers (65 tot 85 jaar oud) hadden daar minder vaak last van. 17 procent van de jonge deelnemers kreeg koorts na de vaccinatie, bij de oudere deelnemers was dat 8 procent. De klachten worden veroorzaakt door de reactie van het immuunsysteem. Bij de meeste mensen zijn de klachten één tot twee dagen na de inenting weer verdwenen. Die bijwerkingen zijn normaal bij vaccins. Bijna alle vaccins geven dit soort lichte klachten.
Tot nu toe zijn er geen andere ernstige bijwerkingen ontdekt. Of het vaccin zulke bijwerkingen heeft op de lange termijn, weten we nog niet, want de testen met dit vaccin zijn een jaar geleden begonnen. Bijwerkingen van vaccinaties op de lange termijn zijn vrij zeldzaam, maar nooit helemaal uit te sluiten tijdens klinische studies. Europese autoriteiten houden de vaccins daarom, ook na de goedkeuring, goed in de gaten.
3. Wat gebeurt er in mijn lichaam zodra het RNA-vaccin ingespoten wordt?
“Het vaccin levert onze lichaamscellen het bouwplan van het spijkereiwit”, zegt Eric Snijder, hoogleraar moleculaire virologie aan het Leids Universitair Medisch Centrum (LUMC). “De eiwitfabrieken in die cellen maken vervolgens het eiwit waarmee ze het immuunsysteem trainen”. Het RNA-vaccin laat het lichaam kennismaken met een stukje van het virus, het spijkereiwit, zodat het immuunsysteem bij een echte infectie sneller kan ingrijpen.
Maar wat gebeurt er nu precies in je lichaam nadat de arts of verpleegkundige de naald uit je arm trekt? Vlak na injectie bevinden de RNA-moleculen, verpakt in vetbolletjes, zich tussen de cellen in ons lichaam, klaar om ‘opgegeten’ te worden door de lichaamscellen. “Cellen zijn aaseters, ze proeven van nature de stofjes uit hun omgeving”, legt vaccinoloog Huckriede uit. “Op die manier weten ze wat er in hun omgeving speelt en zo krijgen ze bovendien hun voedingsstoffen binnen”. Op diezelfde manier eten ze het vaccin op.
In je lichaam worden RNA-moleculen binnen enkele dagen afgebroken.
Wikimedia Commons, Cpl. Jackeline Perez, Riviera, publiek domeinNadat het stukje RNA op zijn bestemming is aangekomen, bouwt de cel spijkereiwitten van het coronavirus na aan de hand van de instructies van het RNA. Die worden op de buitenkant van de cel geplaatst, waar het immuunsysteem het eiwit herkent als vijand. Daarmee is de rol van die cel vervuld. En het stukje RNA dat nog in de cel rondzwemt? Dat blijft niet voor altijd aanwezig. “De cel breekt RNA-moleculen binnen enkele dagen af”, zegt Snijder. “De restanten ervan zijn niet anders dan die van onze eigen tienduizenden RNA-moleculen.”
Immuuncellen herkennen het spijkereiwit op het oppervlak van de lichaamscel als een bedreiging, en slaan groot alarm. B-cellen, de politieagenten van het immuunsysteem, maken neutraliserende antilichamen tegen het spijkereiwit. Tegelijkertijd ruimen de vuilniswagens van het immuunsysteem, de zogenoemde dendritische cellen, cellen met het RNA-vaccin op. Zij activeren weer andere immuuncellen waardoor onze afweer zich klaarmaakt voor de aanval tegen het coronavirus. Dat levert immuniteit op.
Cellen die het RNA-vaccin binnenkrijgen en spijkereiwitten maken, worden door de cellen van ons eigen immuunsysteem gedood en opgeruimd. Maar dat heeft geen gevolgen voor onze gezondheid, verzekert Huckriede ons. “Ons lichaam vervangt die dode cellen weer snel door nieuwe.”
4. Wat nu als het virus muteert?
RNA-virussen muteren aan de lopende band. Het genetische materiaal van zo’n virus is aan willekeurige veranderingen onderhevig, waardoor het virus er net iets anders uit kan gaan zien. Het verandert als het ware iets aan zijn jas, waardoor je immuunsysteem het virus niet meer herkent. Als gevolg daarvan kun je een tweede keer besmet raken door hetzelfde virus. Dit is niet alleen lastig voor je immuunsysteem, maar ook voor de ontwikkeling van een vaccin. We willen natuurlijk niet dat het nieuwe coronavaccin na een jaar niet meer goed werkt, omdat er te veel veranderd is aan de jas van het coronavirus. Hoe houden wetenschappers hier rekening mee?
Onderzoekers houden de genetische code van SARS-COV2 in de gaten, zodat ze op tijd aan de bel kunnen trekken als er toch iets verandert. Tot nu toe zijn er wel spontane veranderingen in de genen van het virus, maar die hebben zelden effect op het uiterlijk of het functioneren van het virus.
Wel vonden onderzoekers corona-virusdeeltjes met een verandering aan de spijkereiwitten. Toch heeft die verandering geen invloed op de opgebouwde immuniteit en de ontwikkeling van vaccins: testen wezen uit dat de antilichamen die ons lichaam aanmaakt tegen de originele versie van het virus nog even goed werken tegen de gemuteerde variant. Het lijkt er dus op dat deze mutatie ons immuunsysteem niet fopt, of de werking van RNA-vaccins in gevaar brengt.
Stel dat er in de toekomst toch een coronavirusdeeltje opduikt dat zijn jas zo sterk heeft aangepast, dat het vaccin niet meer goed werkt. Kan het vaccin dan de prullenbak in? En gaan wij dan weer in lockdown? Marjolein Kikkert, moleculair viroloog aan het Leids Universitair Medisch Centrum (LUMC), gaat in op de vraag. “Als mutaties in het virus het vaccin minder effectief maken, is het relatief makkelijk om het vaccin aan te passen. Alle RNA-vaccins maken namelijk gebruik van dezelfde techniek (zie vraag 1), waarbij het aanpassen van de code eenvoudig is.”
Ook moleculair viroloog Snijder noemt het aanpassen van het vaccin in principe eenvoudig – “Je hoeft alleen de verandering in de code voor het spijkereiwit door te voeren.” Helaas moeten de oude vaccins dan wel de prullenbak in. “Je kunt de oude vaccins, die nog op de plank liggen, niet aanpassen”, verduidelijkt Kikkert, “en het nieuwe vaccin moet dan wel weer in grote hoeveelheden worden geproduceerd.” Geen fluitje van een cent, zegt Snijder; eerder een fluitje van een paar miljard.
Omdat wetenschappers over de hele wereld met hun neus boven op de genetische code van het virus zitten, hoeven we ons voorlopig geen zorgen te maken. Het virus muteert tot nu toe relatief langzaam, en als er relevante veranderingen zijn, merken virologen die direct op. Als het nodig is, kan de productie van een nieuw vaccin dan snel van start.
Lees meer over de coronavarianten:5. Hoe goed en hoe lang beschermt het vaccin me tegen het virus?
Uit de klinische proeven van Pfizer/BioNTech en Moderna bleek dat de werkzaamheid van hun RNA-vaccins zo’n 95 procent is. Dat betekent dat het vaccin in de gecontroleerde omstandigheden van een klinische studie 95 procent van de mensen beschermt wanneer ze met het coronavirus in aanraking komen.
In de echte wereld zal dat wat lager zijn, want de proefpersonen in de klinische studies zijn veelal gezonde mensen die buiten de ‘kwetsbare groepen’ vallen. Maar dat is niet erg, schrijft Zania Stamataki, immunoloog aan de universiteit van Birmingham in ‘The conversation’ : “Weinig vaccins zijn in het echte leven meer dan negentig procent effectief. Het griepvaccin redt met zijn gemiddeld vijftig procent effectiviteit alsnog miljoenen levens ieder jaar”.
De effectiviteit geeft dus aan hoeveel procent van de bevolking het vaccin beschermt, maar zegt niks over de beschermingsduur. Daarover zijn wetenschappers het eens: “Het is nog volledig onduidelijk”, zeggen virologen Kikkert en Huckriede. Wel toonde onderzoek van het RIVM aan dat negen op de tien patiënten een half jaar na besmetting nog steeds antilichamen bij zich dragen. Hoe lang antilichamen na vaccinatie in het bloed blijven is nog niet bekend. Daarvoor volgen wetenschappers de duizenden proefpersonen van de klinische studie twee jaar lang. Ze kijken daarbij niet alleen naar langetermijnbijwerkingen, maar ook naar antilichamen in hun bloed.
6. Waarom moeten RNA-vaccins bij zo’n lage temperatuur bewaard worden en hoe kan het dat die temperatuur per vaccin verschilt?
RNA is erg onstabiel, maar blijft intact bij lage temperatuur. Toch moet Pfizer/BioNTech zijn vaccin opslaan bij zeventig graden onder nul, terwijl het Moderna-vaccin lange tijd stabiel blijft bij vier graden onder het vriespunt.
Wat het verschil in opslagtemperatuur maakt, is moeilijk te zeggen, omdat de formules van de vaccins geheim zijn. Vaccinoloog Huckriede heeft haar vermoedens: “Met chemische aanpassingen in het lab kunnen wetenschappers RNA-moleculen stabieler maken”. Daarnaast biedt het verpakkingsmateriaal van de RNA-moleculen bescherming. Hoewel beide farmaceuten de eerder genoemde vetbolletjes (vraag 1) gebruiken, is er veel variatie mogelijk in de samenstelling ervan. De een biedt meer bescherming dan de ander. Dat is vergelijkbaar met verschillende koks die hetzelfde gerecht bereiden: ieder heeft zijn eigen recept waardoor de smaak net wat anders is.
De opslagtemperatuur blijft een groot nadeel van RNA-vaccins, want bijna geen enkele huisartsenpraktijk, sporthal of andere inentingslocatie in Nederland heeft een vriezer beschikbaar die vaccins kan koelen tot zeventig graden onder nul. Wel blijven de vaccins in de koelkast zo’n vijf dagen goed. Pfizer/BioNTech heeft nu een manier gevonden om de vaccins langer buiten de vriezer te bewaren door ze in vriesdozen met droogijs te plaatsen. Daarin blijft het vaccin ruim twee weken goed, al moeten ze het droogijs wel regelmatig aanvullen. Dat zou een oplossing kunnen zijn voor de logistieke problemen, denkt Huckriede. “Zo kunnen ze de vaccins op een centraal punt opslaan, bijvoorbeeld in een ziekenhuis, en vanuit daar aan inentingslocaties leveren.”
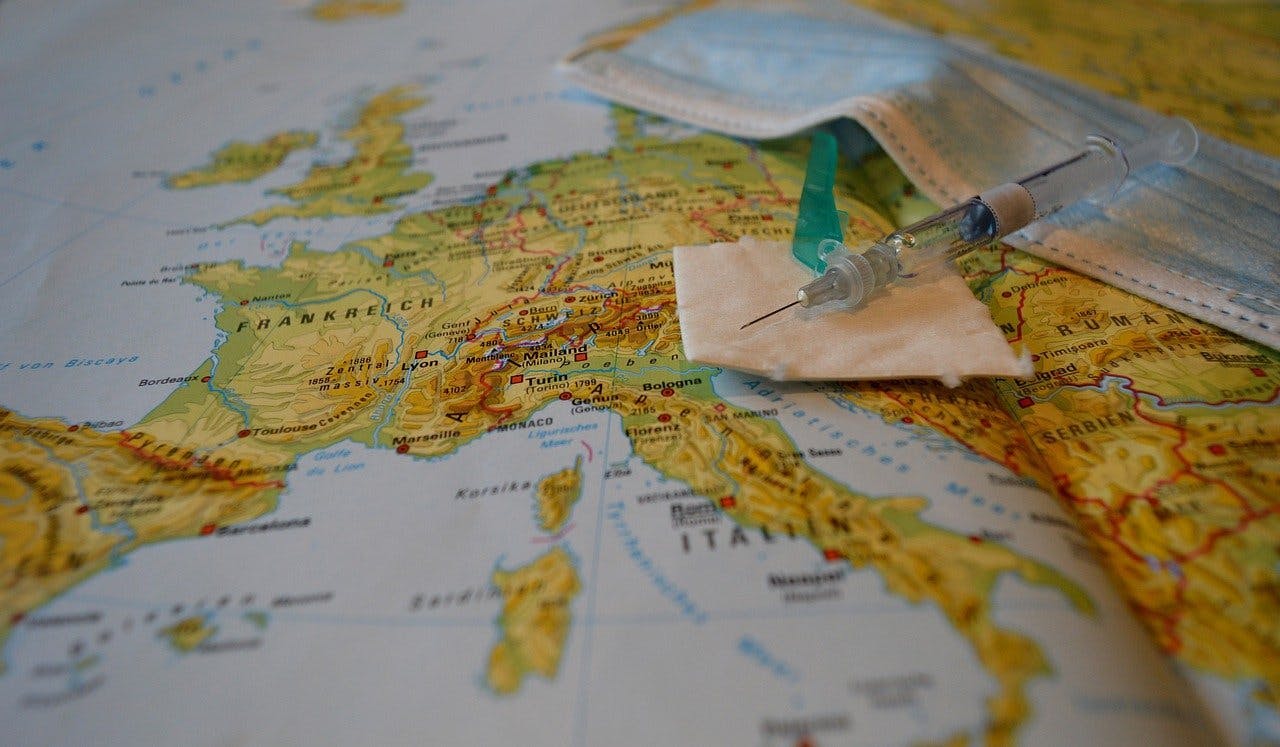
Volgens DHL kunnen slechts 25 landen RNA-vaccins gedurende een langere tijd opslaan.
Pixabay, Frauke Riether via CC0Een ander probleem is dat ultravriezers enorme hoeveelheden elektriciteit verbruiken. En hoewel we in de westerse wereld geen tekort aan stroom hebben, beschikt het merendeel van de wereld niet over die capaciteit. Het transportbedrijf DHL berekende dat slechts 25 landen RNA-vaccins langdurig kunnen opslaan. Daar vallen grote delen van Azië, Zuid-Amerika en Afrika buiten. In 2015 slaagden farmaceutische bedrijven er wel in om het ebolavaccin, dat bij vergelijkbare temperaturen bewaard moet worden, naar Afrika te vervoeren en daar te distribueren. Maar dat ging om slechts enkele honderdduizenden vaccins, in tegenstelling tot de 1,5 miljard vaccins die nu nodig zijn om alle inwoners in Afrika te vaccineren.
Lees meer over de logistieke puzzel rondom het coronavaccin:
Totdat voldoende mensen zijn gevaccineerd, zal de anderhalvemetersamenleving nog blijven bestaan.
Pixabay, klimkin via CC07. Verandert een RNA-vaccin iets aan je DNA?
Nee, het RNA uit RNA-vaccins komt niet bij je DNA en kan dus ook niets veranderen in je DNA. Je DNA zit in de celkern van jouw cellen, en daar kan het RNA uit de vaccins niet komen. RNA-moleculen worden binnen enkele dagen afgebroken door je lichaam. De restanten ervan zijn niet anders dan die van onze eigen tienduizenden RNA-moleculen.