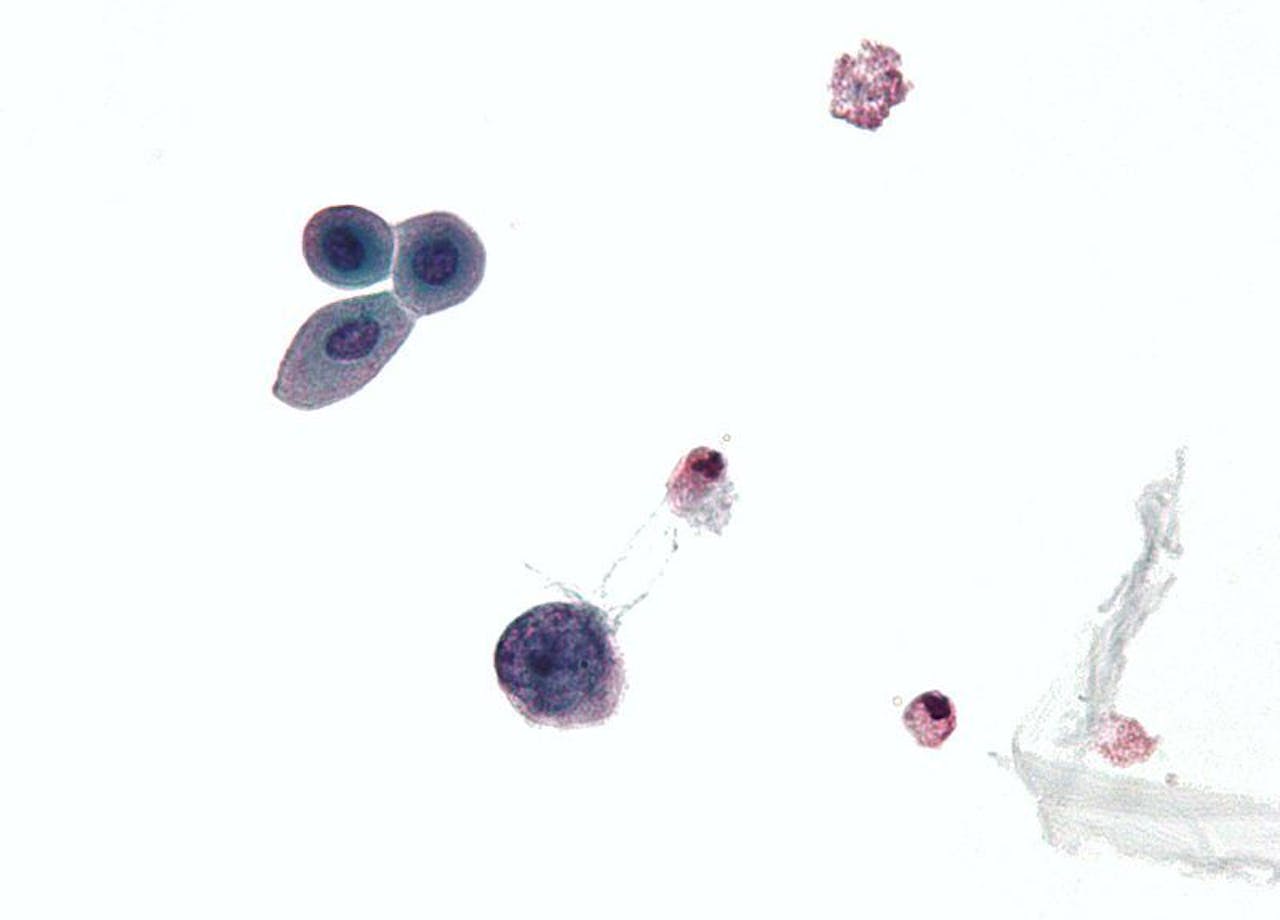
Na een niertransplantatie lopen veel patiënten het risico om hun nieuwe orgaan te verliezen door een infectie met het BK-virus. Onderzoeker Eric van der Veer en zijn team ontdekten een manier om het virus uit te schakelen.
Stel je voor dat je na een lange onzekere periode als nierpatiënt eindelijk een nieuwe nier hebt gekregen, van je broer, zus, of van een onbekende donor. Om afstoting van het orgaan door je eigen lichaam te voorkomen, krijg je medicijnen die je immuunsysteem omlaag brengen. Maar toch word je ziek en je donornier gaat steeds slechter werken. Dit overkomt 35 procent van de 80.000 patiënten wereldwijd die jaarlijks zo’n donororgaan krijgen. De boosdoener: het BK-virus.
Eric van der Veer, moleculair bioloog bij het Leids Universitair Medisch Centrum, raakte per toeval betrokken bij het onderzoek naar dit probleem en ontwikkelt een nieuw medicijn dat het BK-virus uitschakelt.
Per toeval? Vertel!
“Tijdens onze jaarlijkse wetenschapsdag in het LUMC, waar we het publiek vertellen over het onderzoek van onze afdeling, liet een collega onder de microscoop een stukje nier zien dat geïnfecteerd was met het BK-virus. Ik zag cellen die er bruin uitzagen, en schaamde me een beetje dat ik dat virus helemaal niet kende. Terug in mijn eigen kantoor las ik er meer over, en zag dat het vooral een probleem opleverde bij transplantatiepatiënten.”
“Tot die tijd hield ik mij voornamelijk bezig met fundamenteel onderzoek naar RNA-bindende eiwitten. Hartstikke leuk, maar ik miste een brug naar de praktijk. Na die wetenschapsdag kwam ik op het idee om het BK-virus uit te schakelen met RNA-moleculen. We waren blij verrast toen dat zeer goed bleek te werken.”
Waarom was er nog geen behandeling voor dat virus?
“Bijna iedereen draagt het BK-virus bij zich en normaal gesproken hebben we daar geen last van. Maar in veel nierpatiënten die afstotingsonderdrukkende middelen slikken, krijgt het de vrije hand en hoopt het op. Tien procent van hen loopt daardoor ernstige nierschade op. Niemand weet precies hoe je mensen waarin dit virus opspeelt het beste kunt behandelen. Er is geen antiviraal medicijn dat goed werkt. Het enige wat artsen kunnen doen, is de afstotingsonderdrukkende medicijnen verlagen. Maar daardoor neemt het risico van afstoting van het donororgaan toe.”
Waarom wordt de ene patiënt wel ziek en de ander niet?
“Dat is nog een raadsel. Het lijkt willekeurig te zijn, maar mogelijk heeft het te maken met de aanwezigheid van het virus in het donororgaan.”
Hoe werkt jullie nieuwe medicijn?
“Om te overleven gebruikt het virus de menselijke epitheelcellen in de nier. Je kunt het zien als iemand die met een pistool bij een auto aankomt en zegt: ‘Ik ga nu rijden en bepaal waar we naartoe gaan’. Het dwingt de cellen om het virus-genoom te repliceren. Het maakt dan constant virale RNA-moleculen aan. Die coderen vervolgens voor de eiwitten die het nodig heeft om te overleven. Wij hebben een kort stukje RNA ontwikkeld dat bindt aan een belangrijk viraal RNA-molecuul. Daardoor wordt een eiwit dat een sleutelrol speelt bij de overleving van het virus uitgeschakeld. Dat heet RNA-therapie.”
“RNA-therapie is een belangrijke nieuwe methodiek die clinici in de toekomst gaan krijgen om bekende problemen aan te pakken. Van hart- en vaatziekten tot aan kanker.”
Flickr.com, Steven Depolo by CC BY 2.0Dat klinkt veelbelovend, maar is het niet ontzettend duur?
“Op het moment nog wel. Het eerste RNA-medicijn voor een ernstige spierziekte is nu op de markt en daar is een enorm proces aan vooraf gegaan. Maar er worden meer en meer van die therapieën goedgekeurd waardoor het in de toekomst goedkoper gaat worden. Bovendien denken we dat er maar een of twee doseringen van ons medicijn nodig zijn om de virale infectie voldoende te onderdrukken om de nierfunctie te beschermen. We weten dat het BK-virus vooral kan opspelen tussen de derde en negende maand na een niertransplantatie, dus we willen het in die periode injecteren.”
Wanneer is het beschikbaar voor patiënten?
“In het laboratorium werkt het nu goed: de stukjes RNA worden opgenomen door de cellen, vervolgens getransporteerd naar de celkern en de productie van het virus wordt daardoor sterk geremd. Nu willen we stappen richting de kliniek gaan maken. Daarvoor moeten we eerst met een team van experts de veiligheid en de juiste dosering van het medicijn testen. Als dat goed gaat willen we een klinische studie starten waarbij we de eerste twaalf tot vijftien patiënten behandelen.”