Zelf leven van de grond af opbouwen. Uit niks meer dan losse moleculen. Scheikundigen proberen het, maar dat is nog niet makkelijk. In een reeks spoedcursussen praat Kennislink je snel bij over hoe je van een knutseldoos met moleculen tot iets kan komen dat op leven lijkt. Deze week: wat zijn moleculen?
Het eerste wat je moet weten over moleculen is dat ze ontzettend klein zijn. Kleiner dan het kleinste stofje dat je kan zien, kleiner dan bacteriën en de cellen in je huid, kleiner dan het kleinste dat je je voor kan stellen.
In de breedte van een mensenhaar passen 100.000 moleculen naast elkaar.
Wikimedia Commons, Jan Homann via CC0Een mensenhaar is gemiddeld (het verschilt nog al voor blond en bruin haar) 0,1 mm breed. Daar passen ongeveer twintig cellen naast elkaar in. Maar als je moleculen naast elkaar zou leggen dan passen er wel 100.000 naast elkaar in diezelfde 0,1 millimeter. Een enkel molecuul kun je niet zien met een gewone microscoop. Zelfs een elektronenmicroscoop moet daarvoor heel sterk vergroten.
Toch zijn moleculen niet het kleinste dat er bestaat. Bij lange na niet. Ze bestaan zelf ook weer uit nog kleinere deeltjes: de atomen. Elk molecuul is opgebouwd uit twee of meer atomen die met elkaar verbonden zijn. Soms veel meer. Het aantal atomen bepaalt of een molecuul groot is of klein. De kleinste moleculen bestaan uit twee atomen. Een voorbeeld is het zuurstofmolecuul O2 dat zich in de atmosfeer bevindt en dat wij inademen, het is opgebouwd uit twee zuurstofatomen (O). Maar moleculen kunnen ook enorm groot worden: een DNA-molecuul kan bijvoorbeeld vele honderden miljoenen atomen bevatten.
Bouwen met atomen
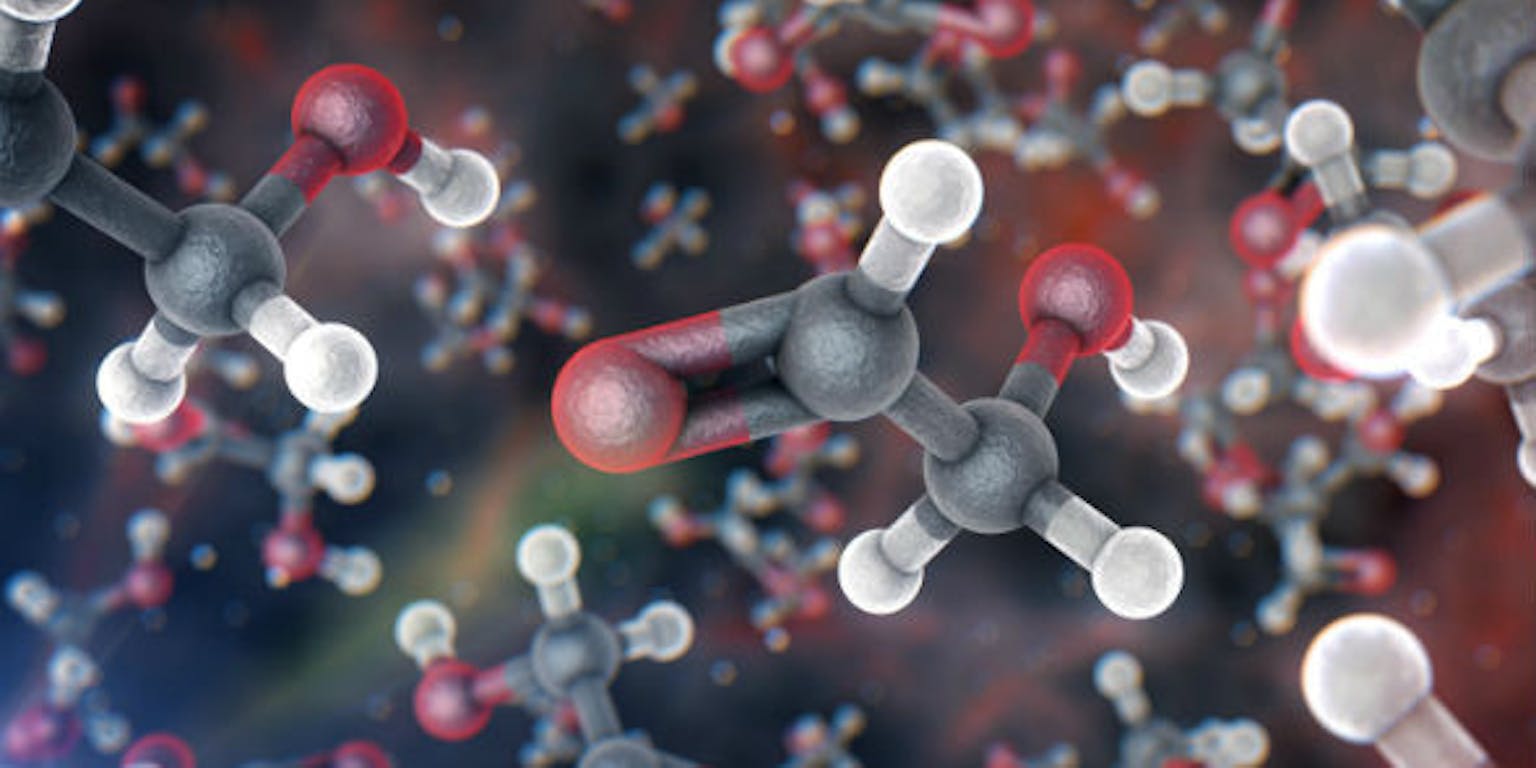
Scheikundigen bedachten manieren om die kleine structuren weer te geven: je kent misschien wel die objecten van gekleurde balletjes en stokjes ertussen. Daarbij stellen de balletjes de atomen voor en de stokjes de bindingen ertussen. Het mooie aan dit model is dat je goed kunt zien dat er allerlei verschillende moleculen mogelijk zijn. Elke kleur bolletje is een ander atoom en als je een goedgevulde bouwdoos met bolletjes en stokjes hebt, dan kun je van alles bouwen.
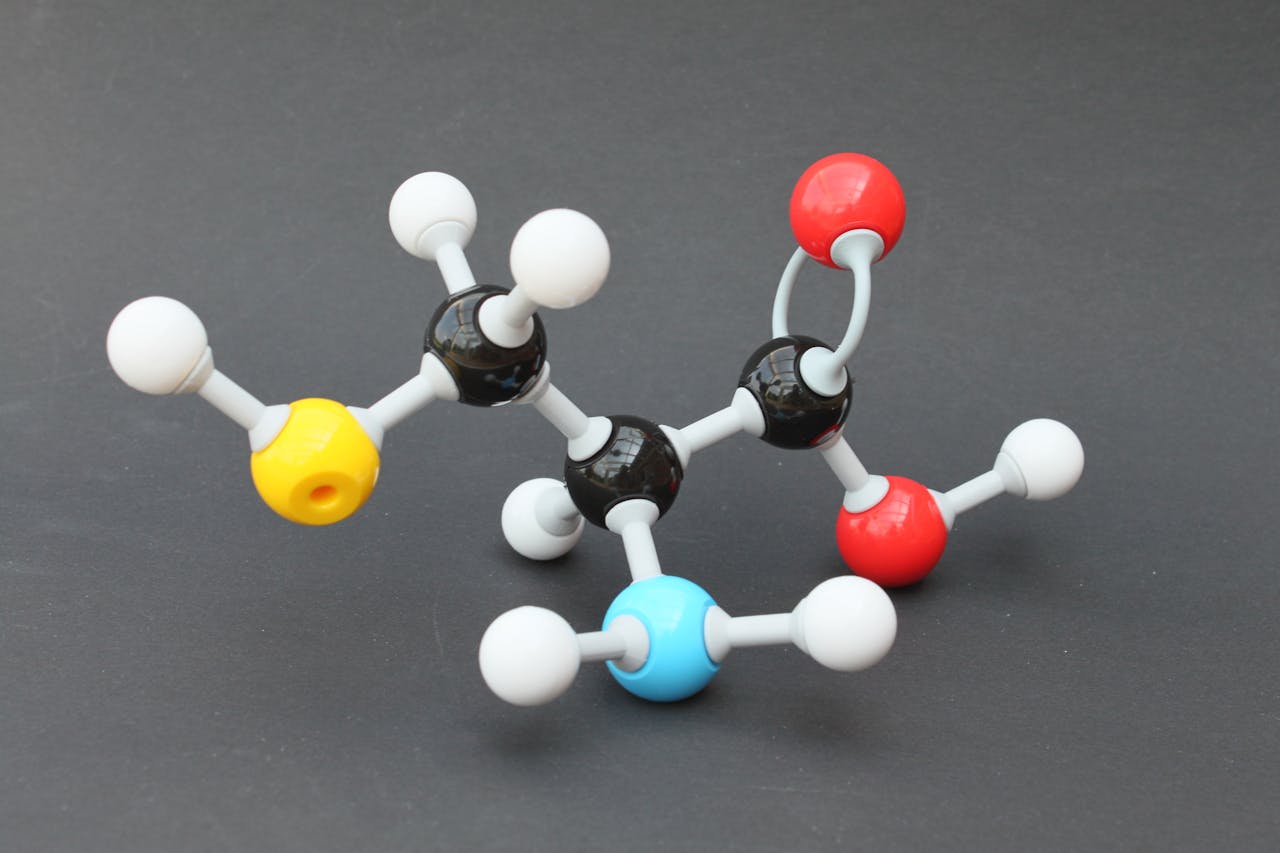
Gekleurde balletjes stellen de atomen voor en de stokjes de bindingen ertussen.
Bin im Garten, via CC BY-SA 3.0Je kan je een molecuul dus voorstellen als een bouwwerk van atomen. Er bestaan meer dan honderd verschillende soorten atomen, hele kleine als waterstof (H) en hele grote als Uranium (U). Een molecuul kan in principe elke soort kiezen als bouwsteen. De soort atomen, het aantal atomen en de manier waarop ze aan elkaar geschakeld zijn, bepaald uiteindelijk welk molecuul het is.
De mogelijkheden lijken eindeloos! En dat zijn ze ook. Dat is dan ook de reden waarom er zo vreselijk veel verschillende soorten moleculen zijn. Inmiddels is het aantal de vijftig miljoen gepasseerd. Naar schatting maken of vinden chemici elke drie seconde een nieuw molecuul. Moleculen kunnen namelijk met elkaar reageren, wat wil zeggen dat ze atomen kunnen uitwisselen of samenvoegen waardoor er weer nieuwe moleculen ontstaan.
Maar wat zijn het?
Goed we snappen nu hoe een molecuul is opgebouwd: een molecuul bestaat uit atomen. Uitleggen wat een molecuul precies ís, is een stuk lastiger. Het is het kleinste deeltje van een stof dat nog de eigenschappen van een stof heeft, is de meest gehoorde beschrijving. Dat is een mooi idee. Hoever kan je een blok hout in stukken hakken tot het geen hout meer is? In de praktijk ligt het toch iets ingewikkelder. Dat wordt duidelijker aan de hand van het volgende voorbeeld.

Zuiver water is niks meer dan heel veel watermoleculen bij elkaar.
wikimediacommonsZuiver water bestaat uit niks meer dan een gigantische verzameling watermoleculen. Een watermolecuul (H2O) bestaat uit één zuurstofatoom en twee waterstofatomen. We noemen het water tot het niveau van dat ene watermolecuul. Toch heeft het lang niet dezelfde eigenschappen als een heleboel watermoleculen bij elkaar: Water in een pannetje kan koken bij 100 graden Celcius; een enkel watermolecuul kan niet koken. Een slootje vol watermoleculen bevriest bij 0 graden Celsius; een enkel watermolecuul niet. Toch draagt dat watermolecuul die eigenschappen wel in zich.
Alles is terug te brengen tot moleculen
En zo zou je elke materiaal om je heen: de stof van je kleren, je glas en je plastic fles, het papier en de tafel waar het op ligt, alles kun je terugbrengen naar de moleculen waaruit het is opgebouwd. Soms een mengsel van verschillende moleculen, zoals de lucht die je inademt, daarin zitten zuurstofmoleculen, maar ook stikstofmoleculen en koolstofdioxidemoleculen en nog veel meer. Soms één soort moleculen als het zout in de zoutpot. Ook jijzelf en de poes op je schoot zijn opgebouwd uit moleculen. Jij en je kat bestaan weliswaar ook uit grotere bouwstenen: de cellen, maar dat zijn grotere ‘levende’ eenheden en die zijn weer opgebouwd uit allerlei verschillende moleculen. Zo is alles terug te brengen tot de moleculen waar het uit bestaat.
Nu ja, niet helemaal alles: er zijn ook stoffen die zijn opgebouwd uit enkel atomen, zoals ijzer en andere metalen. IJzer is een netwerk van ijzeratomen, onderling met elkaar verbonden, waarin geen typische moleculen te onderscheiden zijn. Maar dat zijn de uitzonderingen. En alles in de levende natuur: bossen, beesten, de oceanen en de atmosfeer, heeft moleculen als kleinste bouwstenen.