Steeds meer bacteriën zijn ongevoelig voor bestaande antibiotica. De ontwikkeling van nieuwe medicijnen gaat moeizaam. Daarom zoeken wetenschappers naar een alternatief. Dat lijkt gevonden in virussen (bacteriofagen). Deze fagen zijn in staat een bacterie te infecteren en te doden. Of ze veranderen het genetisch materiaal van een bacterie zo dat hij weer gevoelig wordt voor antibiotica.
Al aan het begin van de twintigste eeuw ontdekten microbiologen bacteriofagen. De ontdekking werd in eerste instantie met veel enthousiasme ontvangen, maar door tegenstrijdige therapeutische resultaten en onvoldoende kennis over de biologische werking van fagen raakten de nuttige virussen al snel in de vergetelheid. Zonde, meent microbioloog Stan Brouns. Hij doet aan de TU Delft onderzoek naar de interacties tussen micro-organismen en bacteriofagen.
Antoinette Hertsenberg over de bacteriofaag in ‘De Wereld Draait Door’ van vrijdag 20 oktober 2017.
Nieuwe functies
“Wij zijn al die jaren afhankelijk geweest van antibiotica, maar nu die niet meer zo goed werken zijn fagen mogelijk ook weer interessant”, vertelt hij. Bacteriofagen zijn veranderlijk en voldoen daarmee niet aan de standaardcriteria van een medicijn. Een faag kan bijvoorbeeld veranderingen aanbrengen in het genetisch materiaal van een bacterie, iets dat een medicijn absoluut niet doet. Brouns snapt wel dat artsen daarom wat huiverig zijn, maar hij merkt ook dat medici zich steeds meer realiseren dat er iets moet gebeuren. “Ik heb contact met wetenschappers in een ziekenhuis om te praten over de mogelijkheden van faagtherapie”, zegt hij.
Die mogelijkheden zijn tweeledig. In de eerste plaats kunnen bacteriofagen direct worden gebruikt voor de behandeling van bacteriële infecties. De faag infecteert de bacterie en doodt deze. Voor deze toepassing zijn met name lytische fagen (zie kader) geschikt. Daarnaast zijn bacteriofagen in staat om genetisch materiaal in een bacterie in te brengen. Voor deze toepassing worden veelal lysogene fagen (zie kader) gebruikt.
In de natuur zijn veel bacteriofagen voor handen, maar die zijn niet per se geschikt voor de behandeling van bacteriële infecties. Synthetische biologie biedt mogelijk uitkomst. Door nieuw DNA aan bestaande fagen toe te voegen, krijgen de virussen functies die ze in de natuur niet hebben.
Beschermde bacteriën
Het doden van bacteriën met lytische fagen klinkt simpel. Er is een infectie, je stuurt er een bacteriofaag op af en weg is de ziekmakende bacterie. Zo eenvoudig is het in de praktijk helaas niet. Bacteriën leven vaak samen in gemengde gemeenschappen (biofilms). Binnen een biofilm liggen individuele bacteriën beschermd, waardoor een bacteriofaag er niet goed bij kan komen. Wetenschappers hebben, met behulp van synthetische biologie, fagen gemaakt die een biofilm herkennen en afbreken.
De fagen werden uitgerust met DNA dat codeert voor Dipersin B, een enzym dat van belang is bij de afbraak van biofilms. Zodra het virus een bacterie infecteert, gaat het complete genetisch materiaal van de faag over naar de bacterie. De machinerie van de bacterie leest het nieuwe DNA af en start met de productie van nieuwe virusdeeltjes en met de productie van Dipersin B.
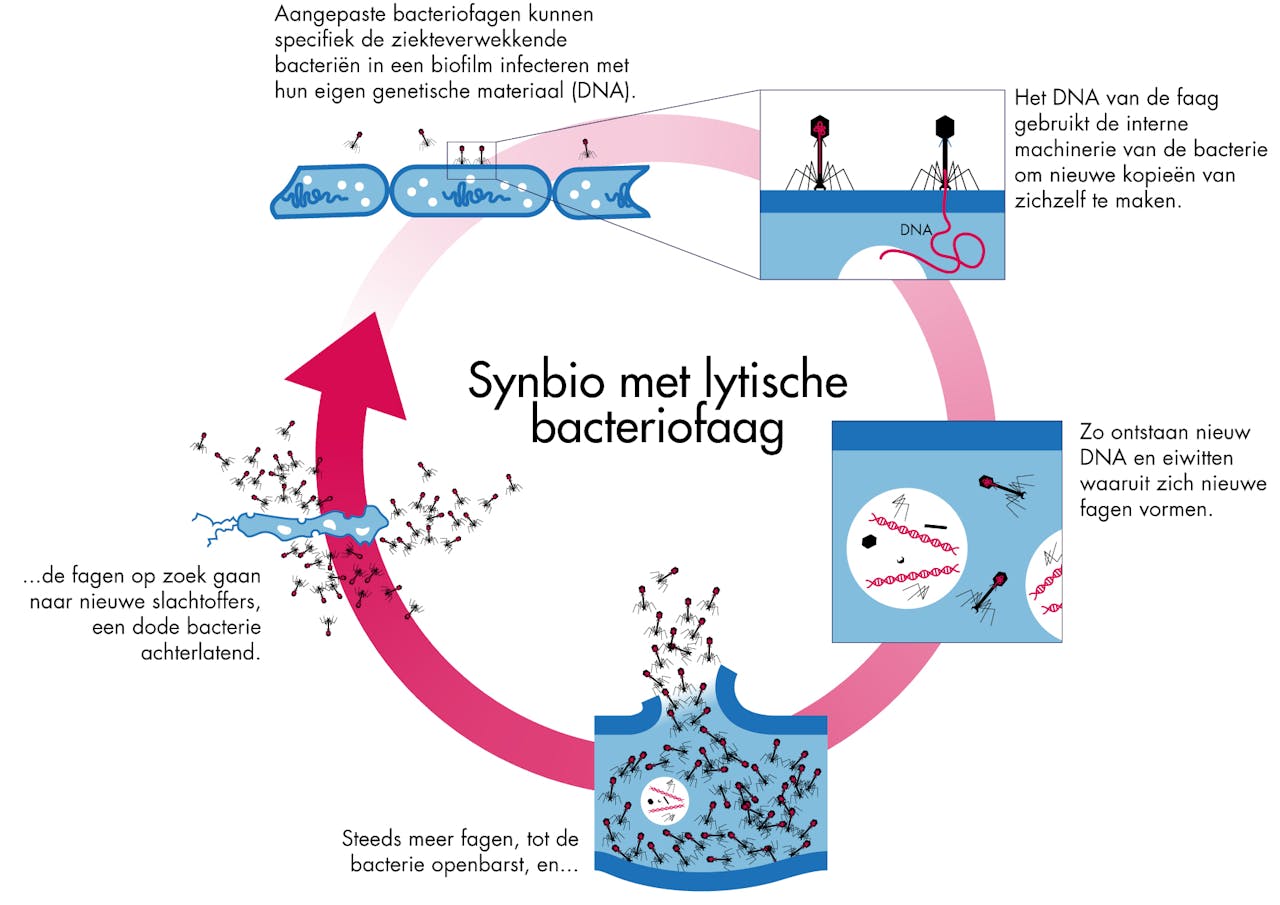
Voorbeeld van een toepassing van synthetische biologie bij een lytische bacteriofaag.
SCICOMVISUALS voor NEMO KennislinkAls de bacterie vol zit met nieuwe virusdeeltjes, spat deze uit elkaar en komen zowel de nieuwe fagen als het aangemaakte Dipersin B vrij. De geïnfecteerde bacteriën gaan hierbij dood. Dipersin B verspreidt zich in de omgeving en drijft bacteriën in de biofilm uit elkaar. De nieuwe virusdeeltjes (die ook weer het DNA dat codeert voor Dipersin B bevatten) infecteren weer nieuwe bacteriën en zo begint de volgende cyclus. De wetenschappers hebben deze cyclus net zo lang herhaald totdat 99,997 procent van een biofilm met E.coli bacteriën was afgebroken.

Model van een bacteriofaag.
Wikimedia Commons, Pascal via CC BY 2.0Infecties aan de oppervlakte
Dat de biofilm bij het gebruik van deze bacteriofagen niet helemaal verdwijnt, is volgens Brouns niet erg. “Voor bacteriën is het goed als er een soort competitie is. Ik weet niet precies wat de optimale percentages zijn, maar het is niet nodig om honderd procent van de schadelijke bacteriën uit een biofilm op te ruimen. Stel dat een bacteriofaag achtennegentig procent van de schadelijke bacteriën weghaalt, dan wordt de overgebleven twee procent wel weggedrukt door concurrentie met andere bacteriën.”
Het Amerikaanse biotechbedrijf EnBiotix test de aangepaste fagen inmiddels bij infecties in gewrichtsprotheses. Een prima toepassing, maar de bacteriofagen doorontwikkelen tot een volledig alternatief voor antibiotica ziet Brouns niet zo snel gebeuren. “Fagen kun je niet inspuiten in de bloedbaan, want het afweersysteem reageert daarop. Met antibiotica heb je daar geen last van, omdat het relatief kleine stoffen zijn. Ik denk dat deze fagen dus met name bruikbaar zijn voor infecties die aan de oppervlakte zitten of op plekken waar de afweer niet bij komt”.
SOS-signaal
Resistente bacteriën weer gevoelig maken voor bestaande antibiotica is een andere optie waarbij synthetische biologie de helpende hand kan bieden. Resistente bacteriën geven een SOS-signaal af op het moment dat antibiotica teveel DNA-schade aanrichten. Dat SOS-signaal activeert speciale resistentiegenen die ervoor zorgen dat de bacterie niet meer op medicijnen reageert.
Wetenschappers hebben twee methoden ontwikkeld om resistente bacteriën weer gevoelig te maken. Zo hebben zij lysogene fagen uitgerust met DNA dat codeert voor LexA3, een algemene onderdrukker van de bacteriële SOS-respons. Op het moment dat zo’n faag een bacterie infecteert, wordt LexA3 ingebouwd in het DNA van de bacterie. Vanaf dat moment is het SOS-signaal onderdrukt en reageert de bacterie dus weer op antibiotica.
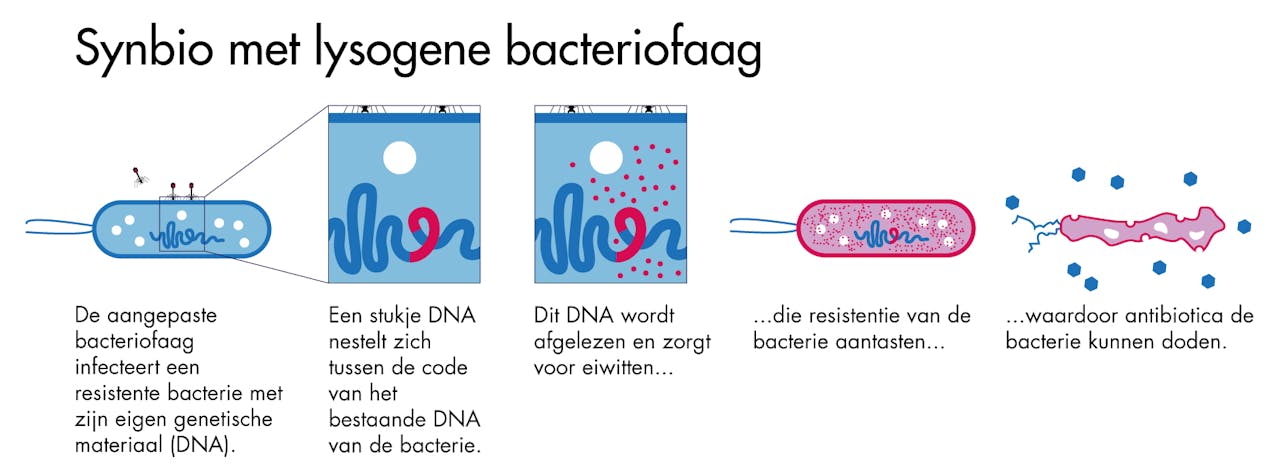
Voorbeeld van een toepassing van synthetische biologie bij een lysogene bacteriofaag.
SCICOMVISUALS voor NEMO KennislinkNog specifieker kan het door gericht, met kleine stukjes RNA, resistentiegenen uit te schakelen. De kleine stukjes RNA binden aan vergelijkbaar RNA van de bacterie en blokkeren op die manier het aflezen van de resistentiegenen. Met behulp van deze methoden is het gelukt om resistente E. coli bacteriën weer gevoelig te maken voor drie verschillende typen antibiotica.
Theoretisch idee
Deze aanpak heeft potentie, maar het risico blijft dat bacteriën ook weer ongevoelig worden voor dergelijke bacteriofagen. Daarnaast zijn praktische toepassingen op dit moment nog moeilijk te implementeren. Volgens Brouns heeft dat vooral te maken met beperkingen in de regelgeving. “Een aangepaste lysogene faag verandert het DNA van de bacterie. Wat je dan krijgt is een genetisch gemodificeerde bacterie en daar is op dit moment geen ervaring mee buiten het laboratorium. Het is bijvoorbeeld niet helemaal zeker of zo’n faag de cellen van het menselijk lichaam met rust laat. Daarom blijft dit voorlopig een theoretisch idee.”
Is het dan nodig om de regelgeving omtrent het knutselen aan organismen te versoepelen? Dat zou heel fijn zijn, denkt Brouns. “Als we gebruik kunnen maken van synthetische biologie, worden de mogelijkheden plotseling veel groter.”

