Beschadigde zenuwen herstellen na een verlamming nauwelijks. Nederlandse wetenschappers kunnen nu zenuwgroei stimuleren met een nieuwe veelbelovende gentherapie. In een verlamde poot van een rat laten zij zenuwvezels zover groeien dat ze de spieren weer bereiken. De ratten weer laten rennen lukt nog niet, maar een belangrijke eerste stap is gezet.
Tijdens een motorongeluk kan je schouder zo’n harde klap krijgen dat de zenuwen bij je hals losgerukt worden van het ruggenmerg, met een verlamming van schouder tot vingertoppen als gevolg. Met een operatie kunnen artsen de zenuwen weer deels aan elkaar krijgen, waarbij enig herstel mogelijk is. Dat herstel reikt vaak niet veel verder dan je schouder, waardoor je de rest van je leven een verlamde arm houdt.
Om te herstellen moet de zenuw vanaf het ruggenmerg de spieren in de vinger weer bereiken, zodat jij je glas water weer kan oppakken. Dat is een flinke afstand, die de beschadigde zenuwen vrijwel nooit meer kunnen overbruggen. Joost Verhaagen, neurobioloog bij het Nederlands Herseninstituut, probeert het teruggroeien van zenuwen te verbeteren. Verlamming in een rattenpoot kon hij nog niet genezen, maar met een recente publicatie in het vakblad Brain lijkt hij zeker op de goede weg te zitten.
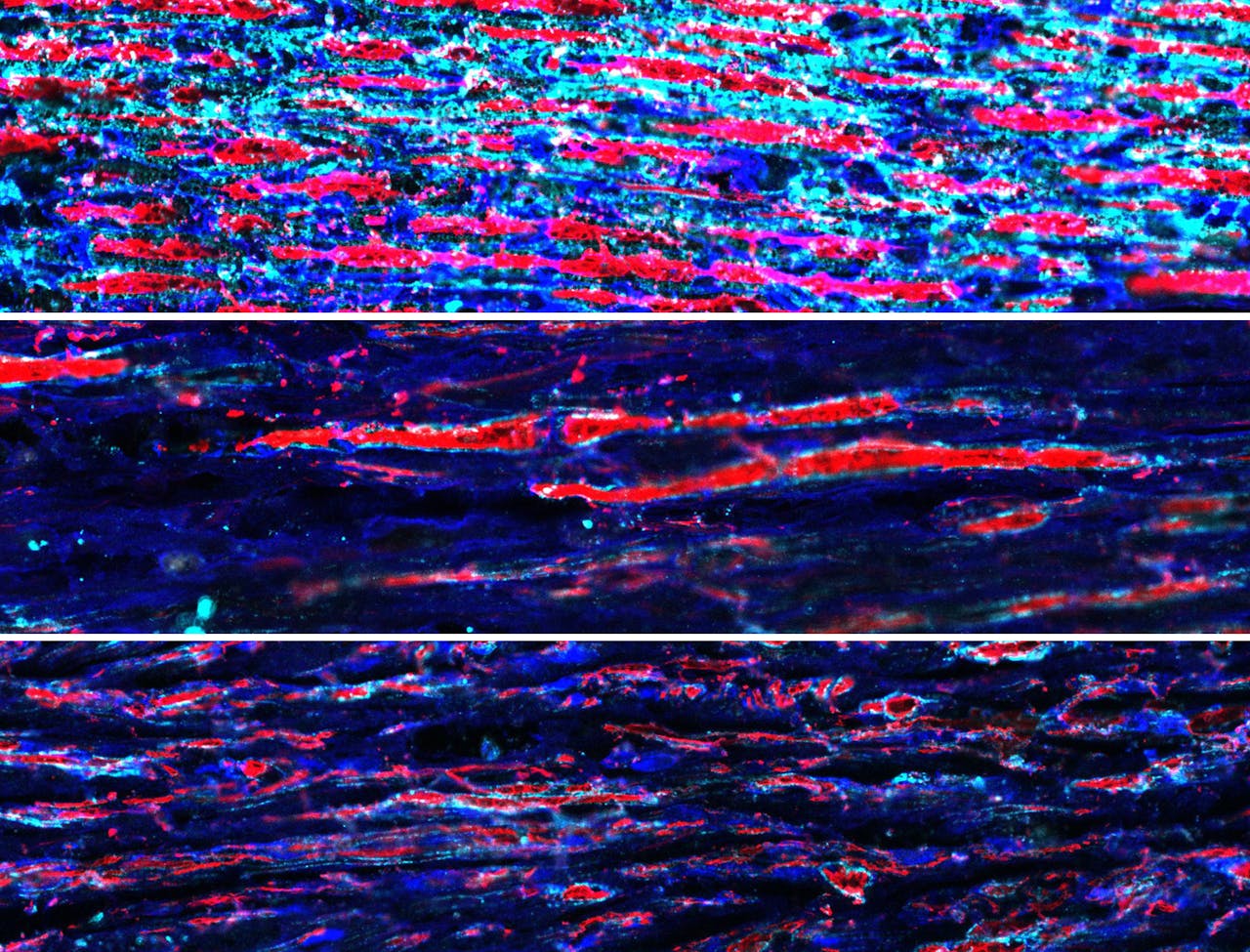
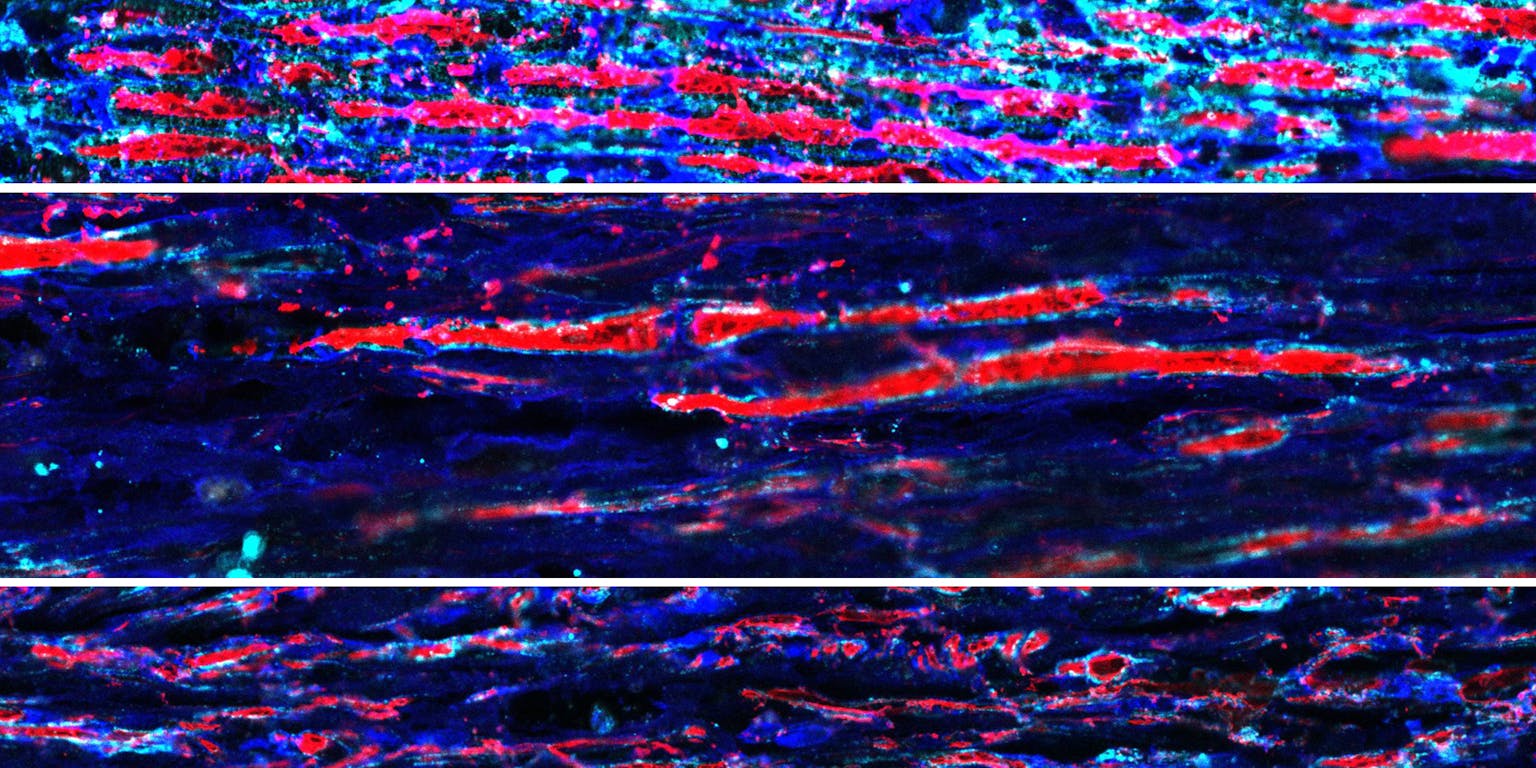
De zenuwvezels zijn hier rood aangekleurd. Het bovenste panel is van een gezonde intacte zenuw met rode zenuwvezels.
Het middelste panel laat een kapotte zenuw zien zonder behandeling. Er zijn enkele vezels spontaan teruggegroeid.
Het onderste panel toont een zenuw die is behandeld met de gentherapie. Er zijn meer zenuwvezels te zien in vergelijking met de onbehandelde zenuw.
Snoepjes doseren
Een zenuw heeft stimulering nodig om de juiste kant op te groeien. Dat gaat met een groeifactor, GDNF. “Groeifactoren zijn als snoepjes”, legt Verhaagen uit. “De zenuw groeit naar het snoepje toe. Daarna moet de zenuw weer doorgroeien naar het volgende snoepje.” Uiteindelijk komt hij zo bij de vingertop uit. Tijdens ontwikkeling in de vroege levensfase maakt het menselijk lichaam dat zelf, maar het gen dat de groeifactor produceert schakelt uit als een kind eenmaal volgroeid is. Om de groei na een trauma weer te stimuleren brachten de onderzoekers een nieuw gen voor GDNF in.
In een eerdere studie had Verhaagen last van overproductie, het door hem genoemde ‘candy store effect’: als er te veel snoepjes zijn, groeit de zenuw niet verder. De zenuw blijft op de plek met veel groeifactor hangen en gaat hier woekeren en verstrengelen. Hierdoor hecht de zenuw niet aan de spier en blijft de poot verlamd. De hoeveelheid groeifactor moest dus subtieler.
Dit keer wist Verhaagen GDNF beter te doseren. De zenuw kon harder groeien zonder te blijven steken in de ‘snoepwinkel’. Daarvoor moest na vier weken de productie van GDNF stoppen. Dit was nauwkeurig te reguleren, omdat een extra ingebracht gen GDNF produceerde. Aan dit gen was een aan/uitknop geschakeld. Een veelgebruikt antibioticum kan deze schakelaar bedienen. Slikken de ratten het antibioticum, dan staat het gen aan en levert het GDNF. Slikken de ratten na vier weken geen antibioticum meer, dan schakelt het gen uit.
De onderzoekers van het Herseninstituut bewezen, samen met onderzoekers van het LUMC, dat een korte periode met GDNF beter werkt en dat dit met gentherapie te reguleren is. Daarnaast wisten zij ook een bekend probleem bij gentherapie te overwinnen: het ontwijken van het afweersysteem.
Afweersysteem gaat in de aanval
Met een leeg, onschadelijk gemaakt virus werd een nieuw GDNF-gen in het lichaam geplaatst. Om daadwerkelijk GDNF te produceren is er nog een extra eiwit nodig. Dat eiwit bindt aan een stukje DNA vlak voor het GDNF-gen. De genen moeten dus ten eerste aangeschakeld zijn met het antibioticum en ten tweede moet er een eiwit aanwezig zijn dat het DNA bindt vlak voor het GDNF-gen. Onder deze voorwaarden produceert de cel groeifactor GDNF dat de zenuw stimuleert om te groeien.
En hier maken we kennis met het probleem, want dat extra eiwit is lichaamsvreemd, het is niet een eiwit van het dier zelf. Het afweersysteem ziet dit als een gevaarlijke indringer en gaat de cellen met het nieuwe gen te lijf. Hierdoor verdwijnen de lokazen om de zenuwgroei te stimuleren.
De oplossing ligt in het lichaamsvreemde eiwit onzichtbaar maken voor het afweersysteem. Hier bestaat een truc voor die Rob Hoeben, moleculair celbioloog bij het Leids Universitair Medisch Centrum, zo’n vijftien jaar geleden onder de knie kreeg. Door nog een extra gen (GAr) te koppelen aan het lichaamsvreemde eiwit, krijgt het een vermomming waardoor het afweersysteem deze niet kan vinden.

Dankzij het GAr eiwit blijft het gen ondetecteerbaar voor het afweersysteem. De bijnaam is daarom ook wel stealth gentherapie. Stealth is een militaire term voor vliegtuigen die niet zichtbaar zijn voor radarsystemen.
Pixabay“Het kostte ons jaren om dit werkend te krijgen. Bij toeval stuitte ik op een publicatie uit 1996 waarin Zweedse onderzoekers een eiwit beschrijven waarmee het menselijke Epstein-Barrvirus onder de radar van het immuunsysteem kan blijven.” Als je dat aan het lichaamsvreemde eiwit koppelt (door de genen achter elkaar te plaatsen), herkent het afweersysteem dit niet. “Een lastige klus, want om twee genen aan elkaar te knutselen moet je het gen kunnen kloneren. Dit GAr-gen is daar heel moeilijk in. Dat is uiteindelijk gelukt, maar dat bleef lang in een labfase. De weg richting een toepassing was lastig, omdat dit een erg complexe methode is.”
Joost Verhaagen was de eerste die dit aandurfde. In een eerdere studie liep hij ertegen aan dat het immuunsysteem de cellen met het nieuwe gen weer afbrak. Dankzij Hoebers’ truc kon hij nu gentherapie toepassen die onzichtbaar is voor het immuunsysteem. Hiervoor zijn er uiteindelijk drie extra genen nodig: een gen dat codeert voor groeifactor waaraan een antibioticagevoelige schakelaar zit, een gen dat codeert voor het extra eiwit dat het groeifactor-gen actief maakt, en een gen om dat extra eiwit onder de radar te houden van het afweersysteem.
Jeroen Pasterkamp, neurowetenschapper bij het UMC Utrecht, is niet betrokken bij het onderzoek en noemt het een zorgvuldige en elegante studie. “Het is heel compleet. De switch met het antibioticum was al bekend, maar ze hebben precies uitgezocht wat er gebeurt als je deze op verschillende momenten uitschakelt. Het is een mooi trucje om de zenuw te laten overleven, maar niet te laten kluwen. En de stealth gentherapie is ook een mooie toevoeging.”

Het is veelbelovend dat zenuwen in de verlamde poot van de rat weer aangroeien. De spieren ontvangen weer signalen, maar nog niet genoeg om de spieren ook te laten bewegen.
FlickrPoot nog verlamd
Weer terug naar de rat die zijn poot niet meer kon bewegen door de losgeraakte zenuwen. De zenuwen werden operatief weer naar de juiste plek geleid en door de gentherapie konden ze weer aan elkaar groeien. In de spieren van de rat was weer activiteit waar te nemen. Er konden dus weer signaaltjes van het ruggenmerg naar de poot lopen, maar dat waren er nog niet genoeg om de poot weer te laten bewegen. “Er waren zo’n tweehonderd zenuwvezels aangegroeid, maar zo’n spier heeft er ongeveer vijftienhonderd”, zegt Verhaagen. “De eerste stap is gezet. Dat zenuwvezels de spier weten te bereiken en ook echt contact maken is heel bemoedigend”, aldus Pasterkamp.
Hoe komt het dat niet alle zenuwvezels aankomen? “Er zijn toch nog enkele van die woekeringen: er bleven nog wat zenuwen in de snoepwinkel achter. Het kan zijn dat de aan/uitknop niet volledig uit staat, waardoor er toch nog wat GDNF in productie blijft. We werken er nu aan om deze aan/uitknop te perfectioneren.” Als meer zenuwen de spier weten te bereiken, kan de rat zijn poot weer bewegen, hoopt Verhaagen.