Depressie tast de cognitieve functies aan. Gelukkig bestaan er medicijnen die de symptomen van depressie onderdrukken. Maar om de aandoening bij de wortel aan te pakken, moet je eerst weten wat er precies verandert bij een depressief persoon – op zowel celniveau als voor het gehele individu – en hoe een bepaald medicijn daarop aangrijpt. Hoe pak je zoiets aan?
Hoe depressie tot stand komt, is niet precies bekend: ongeveer dertig procent is verklaarbaar door genetische oorzaken. De overige zeventig procent wordt veroorzaakt door de omgeving. Toch kunnen onderzoekers gericht onderzoek doen naar de aandoening. Je kunt die namelijk nabootsen in een diermodel.
Goed studiemodel
Dat past bij de werkwijze van onderzoeksconsortium NeuroBasic Pharmaphenomics, dat zich bezighoudt met hersenziekten: schakel bepaalde genen aan of uit in een proefdier om een aandoening na te bootsen, en kijk hoe je die vervolgens kan verhelpen met medicijnen. Alleen, voor depressie zijn de specifieke genen niet bekend. Maar daar blijkt de rat een goed diermodel: in een paar weken kun je ze sociale stress bezorgen, waarna ze de symptomen die horen bij depressie vertonen.
“Dat noemen we een stress-geïnduceerde depressie”, zegt Guus Smit, hoogleraar Neurobiologie aan de Vrije Universiteit van Amsterdam. “Je merkt het aan het gedrag van de dieren. Ze tonen desinteresse voor bijvoorbeeld nieuw speelgoed en hun anticipatie op iets lekkers wordt minder. Dat lijkt sterk op wat je ziet bij depressie.” Ook blijken de dieren minder goed te kunnen onthouden, of nieuwe dingen te leren.
Smit: “De vraag is of je die cognitieve achteruitgang kan opheffen met een bepaald antidepressivum.” Om te zien wat een medicijn doet in het brein, hebben neurobiologen twee manieren. Je kunt een stof direct testen op celniveau zoals een zenuwcel, of je kunt het geven aan een dier en zien wat er gebeurt. Binnen NeuroBasic volgen beide stappen elkaar op, vertelt Smit.
96 kleine vakjes
In vitro testen, bij cellen in een bakje, is dé manier om erachter te komen waar een medicijn precies op aangrijpt en wat er verandert in de cel. Voordeel is ook dat je geen dieren nodig hebt voor dit type onderzoek. Voor het repareren van een defect ben je juist op zoek naar een stof die dat defect opheft. Dan kom je bij cellulaire pharmaphenomics, zegt Smit: in vitro uitlezen wat een stof doet met een zenuwcel. Een medicijn moet de problemen van een ‘zieke’ zenuwcel kunnen oplossen, bijvoorbeeld het niet goed uitgroeien van de cel, het slecht doorgeven van elektrische signalen of het te weinig vertakken van de zenuwcel.
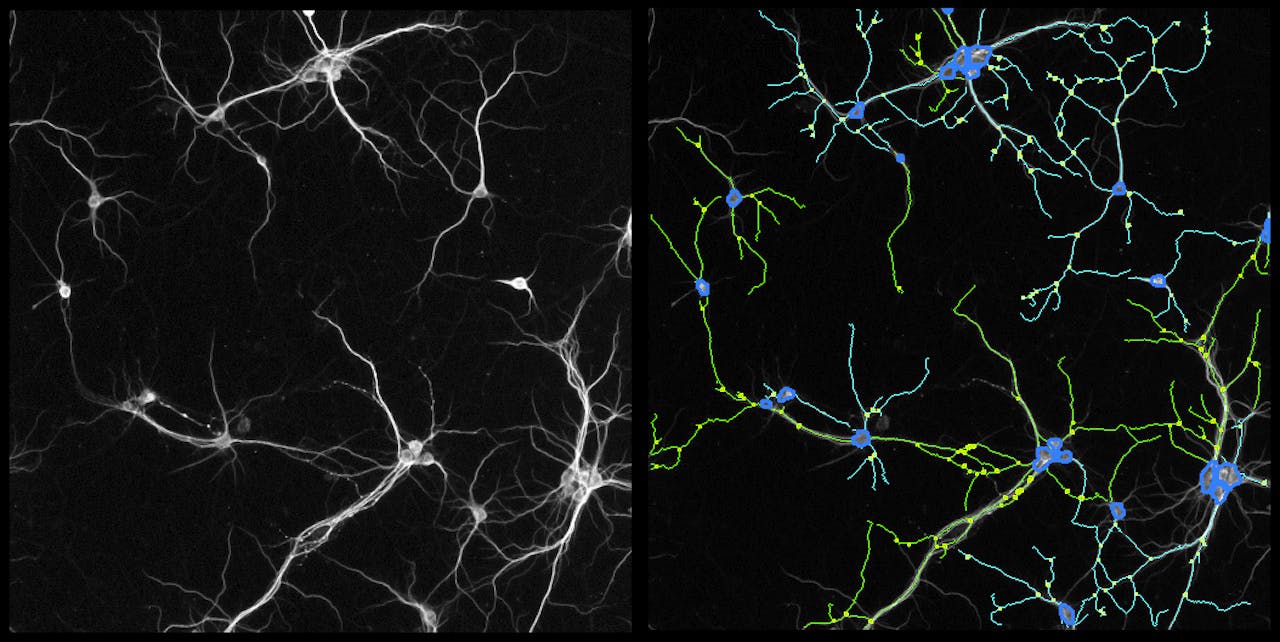
In vitro gekweekte zenuwcellen met uitlopers (dendrieten). In de rechterfoto zijn de dendrieten aangekleurd door de computer.
R.E. van Kesteren, CNCR, VUWaar het testen van medicijnen op andere typen cellen allang mogelijk is, blijkt dat voor zenuwcellen oftewel neuronen nog niet zo eenvoudig. Smit: “Werken met neuronen is echt een vak apart.” Neuronen moet je eerst laten uitgroeien voor je er goed naar kunt kijken. De cellen vormen namelijk een netwerk, waarbij ze via synapsen contact maken met andere neuronen. Pas in dat hele netwerk kun je alle parameters voor hun functioneren echt goed bekijken.
Het doel van Smit en collega’s was om het uitlezen van die parameters makkelijker te maken. De onderzoekers ontwikkelden software om met een microscoop en een computer automatisch een 96-well-plate, een rooster van 96 kleine vakjes met cellen, te analyseren. “Met antilichamen kun je bijvoorbeeld de celkern of het cytoskelet van een neuron kleuren, waardoor de computer die goed kan registreren”, legt Smit uit. De analyse werkt met confocale microscopie, waarbij een microscoop telkens scherp stelt op een klein puntje van het geheel, waardoor het gecombineerde beeld een hoge resolutie heeft.

Een 96-well-plate: een rooster van 96 kleine vakjes met cellen, die door de computer geanalyseerd kunnen worden.
R.E. van Kesteren, CNCR, VUEnorm veel gegevens
Een onderzoeker die wil weten welk medicijn mogelijk werkt voor cellen met bijvoorbeeld Alzheimer-genen, kan zo op grote schaal verschillende stoffen in andere doseringen testen. Smit: “Wij hebben een proof of concept laten zien: je kunt zien welke elementen worden aangetast of veranderd, ook als dat maar heel subtiel is: de hoeveelheid synapsen kan nét anders zijn, of de cellen groeien minder uit.”
Van tevoren was het niet zeker of dit zou lukken, zegt Smit. “Het is een heel gedoe om de computer neuronen met alle zeer dun uitlopende takjes te laten herkennen. Je hebt het ook over enorm veel gegevens, met zoveel cellen tegelijk: vijfduizend per vakje, en dat 96 keer, voor alle parameters. Maar de methode is nu reproduceerbaar.”
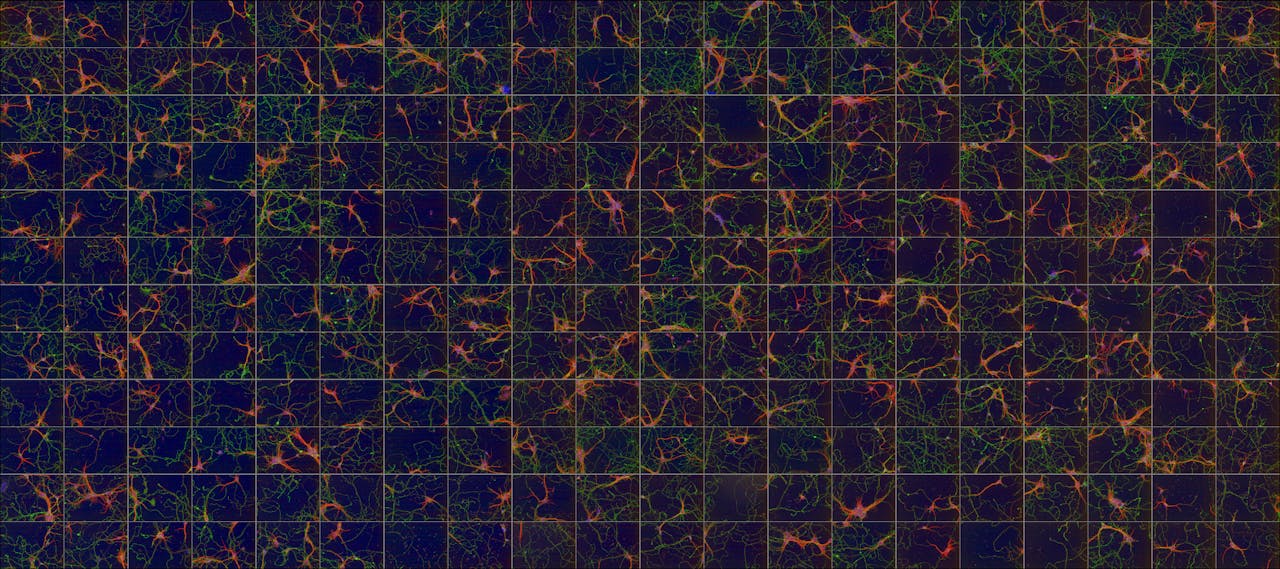
Een overzicht van neuronen die in vitro zijn gekweekt om ze te testen. Omdat ze aangekleurd zijn kan de computer ze herkennen.
R.E. van Kesteren, CNCR, VUNu kan de onderzoeker op zo’n plaat dus zien wat het medicijn op celniveau doet, in de vorm van output als ‘meer synapsen’ of ‘meer signaal’. Maar testen op cellen is natuurlijk niet genoeg om te weten of een stof werkt: je wilt ook de reactie van het hele systeem zien. “Het is belangrijk om te kijken in relevant weefsel; van cellen in een vakje weet je niet precies hoe ze zijn aangelegd en of dat overeenkomt met de intacte hersenen.” Stimuleer je bepaalde plekken in een stukje weefsel uit de hersenen van een rat of muis, dan kun je zien hoe die signalen worden doorgegeven en hoe andere cellen reageren.
Verschillende niveaus
En dat brengt ons terug bij de depressieve ratten. Ook daar wilden onderzoekers weten wat een medicijn voor uitwerking heeft op het hele systeem. Zij bestudeerden wat er precies verandert in de hippocampus van de dieren, wanneer ze depressief waren gemaakt. Bepaalde genen blijken dan opeens te worden onderdrukt. Met name de extracellulaire matrix – een soort skelet rondom de hersencellen – neemt enorm toe, waardoor de plasticiteit van de hersenen omlaag gaat. Sommige antidepressiva (middelen tegen depressie) remmen de toename van extracellulaire matrix, vertelt Smit. Signalen worden dan beter doorgegeven en de hersenen kunnen zich nog aanpassen.

De CognitionWall is een voorbeeld van een test die inzicht geeft in de effecten van een stof op het gedrag van een individu.
SylicsVoor de volgende stap zoomt Smit nog verder uit: wat zijn de consequenties van een stof voor het hele individu? “Je moet die verschillende niveaus altijd in beeld houden”, zegt Smit. “Vind je iets op celniveau, dan moet het ook werken in een intact brein, en het gewenste effect hebben op het functioneren en gedrag.”
Tests die geschikt zijn om veranderingen in bijvoorbeeld cognitieve functies of motivatie te testen zijn bijvoorbeeld de Erasmusladder of de CognitionWall. Pas als een medicijn al die keuringen goed heeft doorstaan, kan het door naar de klinische test.