Immuuntherapie tegen kanker is volop in ontwikkeling. Daarvoor zijn antilichamen nodig, de stoffen die binden aan de tumorcel. Met een nieuwe techniek, ontwikkeld door onderzoekers in Nijmegen en Leiden, kunnen laboratoria nu snel en goedkoop precies het juiste antilichaam maken.
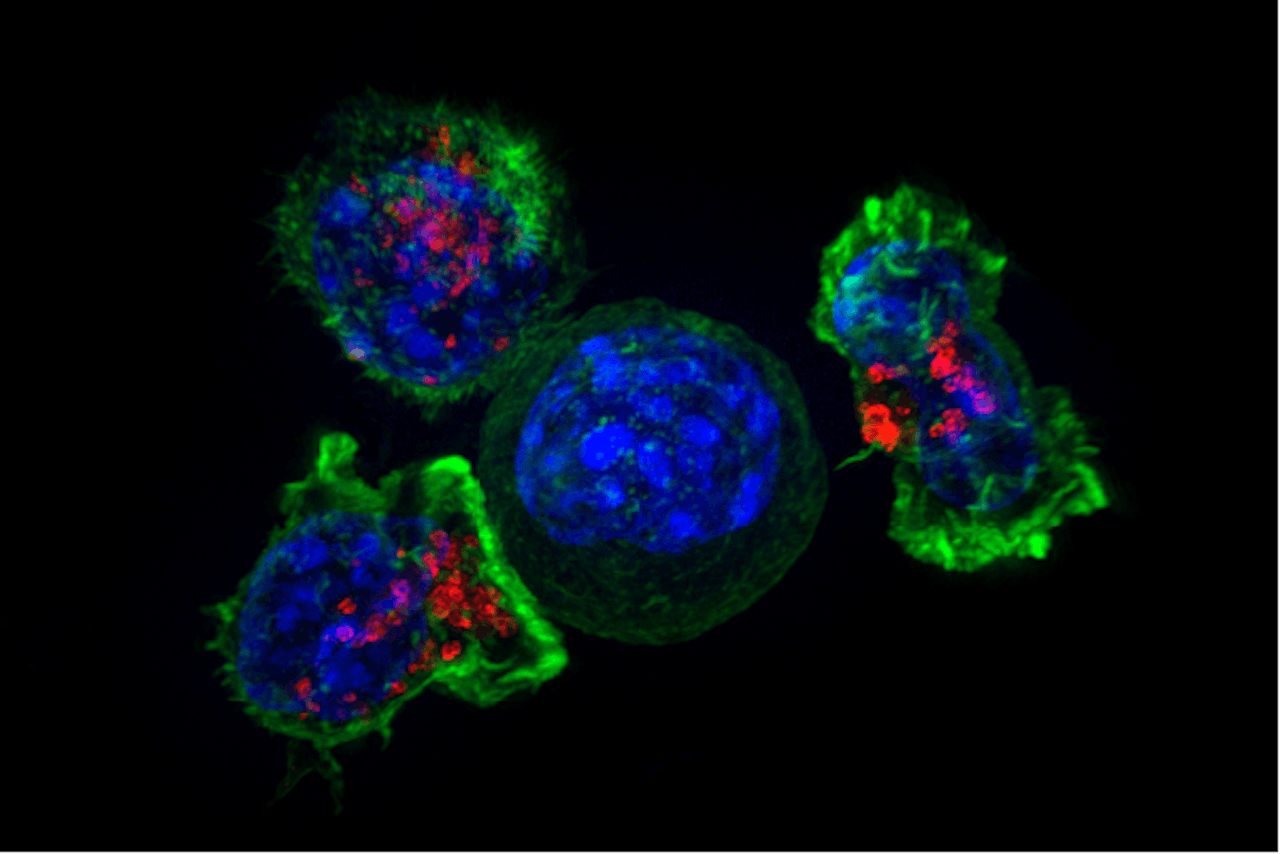
In het midden een kankercel die wordt aangevallen door drie ‘killer’ T-cellen van het immuunsysteem.
NIH via Wikimedia Commons, publiek domeinOm ons lichaam gezond te houden is het belangrijk dat alles wat ‘vreemd’ – en mogelijk gevaarlijk – is snel wordt herkend en gemarkeerd, zodat gepaste actie volgt. In dit proces spelen antilichamen, ook vaak antistoffen genoemd, een cruciale rol. Antilichamen herkennen heel specifiek een stukje eiwit op bijvoorbeeld een virus of een bacterie, plakken zichzelf eraan vast, wat het signaal is voor andere onderdelen van het immuunsysteem om de indringer te vernietigen.
Dat werkt niet alleen zo bij bedreigingen van buitenaf. Ook voor interne gevaren, zoals tumorcellen, bestaan antilichamen die tumoren herkennen en eraan binden. Tumoren werpen echter allerlei blokkades op, waardoor het immuunsysteem niet echt een vuist kan maken. Door specifieke antilichamen toe te dienen die de blokkades opheffen, geef je het immuunsysteem een extra zetje om de kankercellen te vernietigen. Dat is het principe achter immuuntherapie.
Onverwachte werking
De ontwikkeling van immuuntherapie gaat de laatste jaren razendsnel. Wereldwijd zijn op dit moment honderden studies met patiënten gaande. De resultaten variëren van ronduit spectaculair tot nauwelijks een effect. “Er zijn veel studies gestart zonder dat het mechanisme achter de werking van het antilichaam duidelijk was”, zegt Martijn Verdoes, groepsleider op de afdeling tumor-immunologie van het Radboudumc in Nijmegen. “Inmiddels is duidelijk dat sommige antilichamen heel anders werken dan gedacht. Ze blijken niet de blokkade op te heffen zoals de bedoeling was, maar ze zorgen ervoor dat de blokkerende cellen worden vernietigd.” Het is belangrijk om te weten hoe een antilichaam precies werkt, zodat de behandeling verbeterd kan worden en precies gericht is op de kankercellen.
Het onverwachte gedrag van antilichamen kan voortkomen uit het zogeheten isotype, dat aangeeft uit welk type immunoglobuline (Ig), een klasse van eiwitten, het antilichaam is opgebouwd. Antilichamen zijn grote eiwitten in de vorm van een Y, waarvan de bovenste twee pootjes zorgen voor de specifieke herkenning. Jarenlang is vrijwel alle aandacht uitgegaan naar het gericht aanpassen van deze stukjes om antilichamen te maken met nieuwe, gewenste eigenschappen. Maar de ‘stam’ van een antilichaam hangt er niet zomaar een beetje bij. “Dat deel wordt herkend door bepaalde immuuncellen en kan daaraan binden. Of en aan welke immuuncel de stam bindt, wordt bepaald door het isotype”, legt Verdoes uit. Dat betekent dat antilichamen met dezelfde bovenkant, maar met verschillende isotypen een heel andere werking kunnen vertonen. Vooraf testen welk isotype het beste resultaat geeft is dus verstandig.
Cellen combineren
De oplossing lijkt eenvoudig: zorg ervoor dat je antilichaam meteen het gewenste isotype heeft, dan weet je precies wat je kunt verwachten. Voor de productie van antilichamen wordt al tientallen jaren de hybridoma-technologie gebruikt. In het kort: je spuit een proefdier in met de stof waartegen je een antilichaam wil hebben. De B-cellen van het immuunsysteem van het dier gaan in reactie daarop dat specifieke antilichaam maken. Vervolgens haal je die B-cellen uit het dier en je combineert ze met onsterfelijk gemaakte cellen, meestal aangepaste kankercellen. Het resultaat is een hybridoma-cel, een combinatiecel die je eindeloos kunt kweken en die het gewenste antilichaam blijft maken.
“Die technologie werkt heel goed, maar het probleem is dat je geen controle hebt over het isotype dat je krijgt”, zegt Verdoes. “Nou zijn er wel mogelijkheden om alsnog de stam van het antilichaam aan te passen naar het gewenste isotype, maar dat is technisch behoorlijk ingewikkeld en heel arbeidsintensief. Er zijn ook gespecialiseerde bedrijven die dat voor je kunnen doen, maar dat is veel te duur voor een gewoon universitair onderzoekslab.”
Een oplossing voor deze volgens Verdoes frustrerende situatie kwam in zicht met de opkomst van de CRISPR-technologie, een methode om heel gericht in het DNA te kunnen knippen en plakken. “Samen met Ferenc Scheeren van het Leids Universitair Medisch Centrum kwamen we op het idee om met CRISPR in hybridoma’s het DNA dat codeert voor het antilichaam zodanig aan te passen dat je het gewenste isotype krijgt. En dat werkt. Het mooie is dat onze aanpak snel en eenvoudig uit te voeren is, zonder enorme kosten, waardoor je nu gemakkelijk veel verschillende antilichamen met verschillende isotypen kunt maken die je al heel vroeg in het proces kunt testen op hun effect en specifieke werking. Dat lijkt ons heel nuttig om beter en sneller te bepalen of een antilichaam uiteindelijk geschikt is om in patiënten te testen.”
Grote voorraad
Omdat de hybridoma-technologie al zo lang wordt gebruikt, is er inmiddels een ongekende hoeveelheid aan antilichaam-producerende cellen beschikbaar, aldus Verdoes. “We hebben hier al een aardige voorraad aan verschillende hybridoma’s in de vriezer. Ik denk dat er wereldwijd wel miljoenen zijn gemaakt. Daar kun je meteen mee aan de slag, je hoeft niet eerst ook nog nieuwe hybridoma’s te maken.”
De nieuwe techniek maakt het ook mogelijk in het antilichaam nog meer veranderingen aan te brengen, waardoor je er naderhand nog van alles mee kunt doen. Verdoes: “Je kunt bijvoorbeeld meteen bindingsplaatsen inbouwen waar je een kleurstof aan kunt plakken. Dat kun je gebruiken om antilichamen ook bij de diagnose te gebruiken om kankercellen op te sporen.” Maken onderzoekers er al gebruik van? “Jazeker, er zijn meerdere samenwerkingen gaande. Iedereen mag onze methode gebruiken en alle informatie is gewoon vrij beschikbaar.”