De oudste mens ter wereld werd 122. Zij lijkt de uitzondering die de regel bevestigt: onze biologische grens ligt bij 120 jaar. We duiken in de celbiologie op zoek naar verklaringen.
In 1997 stierf Jeanne Louise Calment op de rijpe leeftijd van 122 jaar en vijf maanden. Daarmee werd de Française niet alleen officieel de oudste inwoner van Frankrijk en Europa, maar ook de oudst bevestigde persoon ter wereld. Bijna dertig jaar later ligt die titel nog steeds bij Calment, en de kans is groot ze die ook nog wel even zal houden. Vooralsnog lijkt pakweg twaalf decennia namelijk de biologische bovengrens te zijn. Hoe gezond je ook leeft, hoe gunstig je genen je ook gezind zijn, en hoe veilig je leefomgeving ook is: langer houdt ons lichaam het simpelweg niet vol.
In 2013 kwam een groep verouderingswetenschappers met een verklaring hiervoor. In het wetenschappelijke tijdschrift Cell wezen zij negen pijlers van veroudering aan: negen processen die op celniveau leiden tot de functionele, lichamelijke achteruitgang die gepaard gaat met verouderen én daarmee het onontkoombare gevolg: de dood. We zetten de pijlers voor je op een rij en kijken of er misschien ergens speelruimte te vinden is.
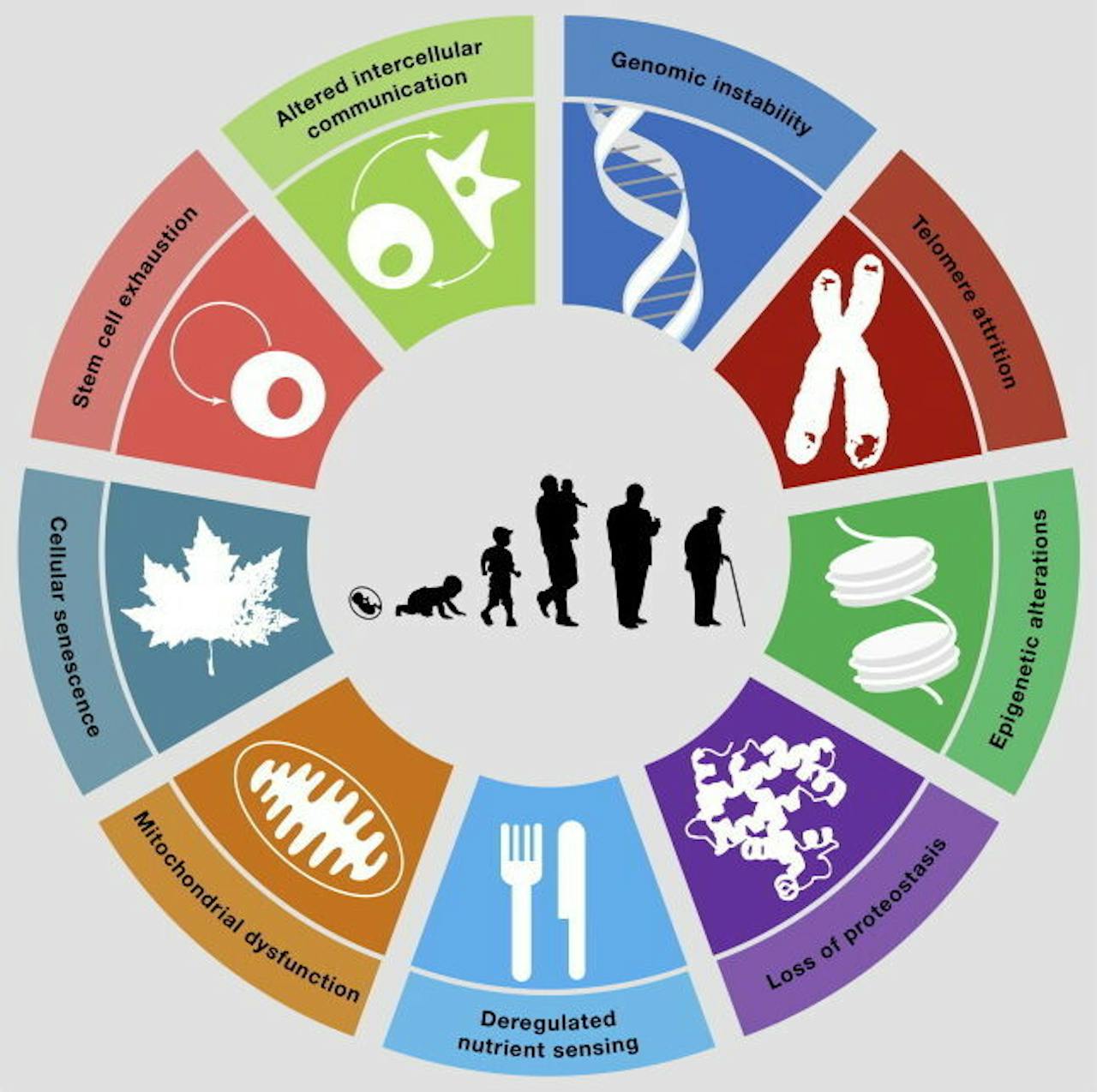
Schematisch overzicht van de negen pijlers van veroudering. In ons overzicht beginnen we bovenaan en gaan we met de klok mee alle pijlers af.
López-Otín (2013)Onleesbare handleiding
Als een soort blauwdruk bevat ons genoom de instructies voor alle processen in het lichaam. Het is dus belangrijk dat deze genetische handleiding niet beschadigd raakt. Maar helaas, hoewel het in de celkern van onze cellen relatief veilig ligt opgeslagen, sluipen er tijdens ons leven toch foutjes in. Door blootstelling aan uv-straling bijvoorbeeld of als het kopiëren van deze blauwdruk voor een nieuwe cel niet helemaal vlekkeloos verloopt. Met het verstrijken van de jaren stapelen zich meer en meer foutjes op in je genetische materiaal en worden die ook steeds minder goed hersteld. Hoe meer foutjes, hoe minder goed je cellen en daarmee je lichaam werken.
Een internationaal team van onderzoekers meldde in 2017 dat de stof NMN (nicotinamide mononucleotide) zou kunnen helpen het DNA-herstel wat langer op peil te houden. In muizen zorgde behandeling met de stof, een voorvorm van het essentiële enzym NAD (nicotinamide adenine dinucleotide), voor vermindering van leeftijdsgerelateerde schade aan het DNA. Hoewel er ondertussen ook een handvol klinische proeven met NMN is gedaan, is de werkelijke effectiviteit van de stof op menselijke veroudering niet wetenschappelijk bewezen. Ook zijn mogelijke risico's van het gebruik van NMN nog onduidelijk.
Afgesleten dopjes
Met elke celdeling verkort het ‘dopje’ dat de uiteindes van onze chromosomen, de dragers van ons genetisch materiaal, beschermt: de telomeer. Als de telomeer, vergelijkbaar met het plastic of metalen uiteinde van een schoenveter, ‘op’ is, deelt de cel niet meer verder en kan hij niet meer overleven.
In onderzoek bij muizen lukte het wetenschappers de telomeren te verlengen. Met succes: de leeftijd van de proefdiertjes steeg met maar liefst twintig procent. In 2015 heeft voor het eerst ook een mens een verlengingsbehandeling ondergaan: Elizabeth Parrish, oprichter van het Amerikaanse biotech-bedrijf BioViva. Het is nog altijd de vraag of de controversiële behandeling, die Parrish in een anonieme kliniek in Colombia heeft laten uitvoeren, werkt.
Telomeren (rood) aan chromosomen
iStockAangepaste instellingen
Elke cel in je lichaam bevat dezelfde kopie van het genoom. Toch zijn niet alle cellen hetzelfde. Dit is deels te wijten aan het epigenoom, een besturingssysteem dat stukken van het genoom aan of uit kan zetten. Tijdens veroudering raakt dit systeem verstoord.
Door middel van ‘epigenetisch herprogrammeren’ proberen wetenschappers de klok terug te draaien en het genoom terug te brengen naar de originele instellingen. Bij muizen en apen zijn de eerste studies al – met voorzichtig succes – uitgevoerd, maar wetenschappers vragen zich af of we op korte termijn klaar zullen zijn voor toepassing bij mensen.
Ontregelde eiwitten
De hoeveelheid, structuur en vorm van de eiwitten die een cel nodig heeft om te functioneren, raken bij het ouder worden verstoord. Verkeerd gevouwen eiwitten kunnen hun taak niet meer goed uitvoeren en sommige kunnen zelfs actief schade aan de cel toebrengen. Hoewel dergelijke eiwitten meestal worden opgeruimd en gerecycled, gebeurt dat niet snel genoeg om te voorkomen dat je er op je ouwe dag flink wat hebt opgespaard.
Voorbeelden van schadelijke effecten van zulke ontregelde eiwitten zijn de ontwikkeling van de ziekte van Alzheimer en de ziekte van Parkinson. Bij beide verouderingsziekten vind je opeenhopingen van verkeerd gevouwen eiwitten in de hersenen. Het aminozuur tryptofaan kan misschien bescherming bieden tegen deze schadelijke klontering, zo laat onderzoek bij wormen zien.
Opname van voedingsstoffen
Cellen hebben voedingsstoffen nodig om hun taken uit te voeren, zoals suikers, vetten en aminozuren. Om te weten met wat voor tempo ze dat kunnen doen, moeten cellen ook weten hoeveel er van die voedingsstoffen beschikbaar zijn. Moleculaire dectectienetwerken meten de concentraties voedingsstoffen en werken als een rem of juist als een gaspedaal voor de werkzaamheden van de cellen. Naarmate de jaren vorderen vinden cellen de voedingsstoffen steeds minder goed. Hierdoor worden cellen minder functioneel.
Onderzoekers zoeken naar manieren op de detectienetwerken aan de gang te houden. In 2009 wisten Amerikaanse wetenschappers met de stof rapamycine een zo’n netwerk in oudere muizen af te remmen. De muizen bleven hiervoor langer gezond.
Gebrekkige energiecentrales
Naarmate je leeftijd oploopt, raken de energiecentrales van onze cellen, de mitochondriën, beschadigd en werken ze steeds minder goed. Hierdoor hebben cellen minder energie om hun taken uit te voeren.
Verschillende ouderdomsgerelateerde ziektes, zoals diabetes type 2 en neurodegeneratieve ziekten Alzheimer en Parkinson, zijn gelinkt aan de teloorgang van de mitochondriën. Onderzoekers zijn volop op zoek naar de precieze mechanismen achter deze achteruitgang. Vorig jaar nog wisten Amerikaanse celbiologen het eiwit FNIP1 aan te wijzen als ontbrekende schakel in het proces verantwoordelijk voor het vinden, elimineren en vervangen van beschadigde mitochondriën.
Mitochondriën
iStockZombiecellen
Met het verstrijken van de tijd stapelen er in je lichaam steeds meer verouderde, beschadigde cellen op. Deze zogenaamde senescente cellen leven nog, maar zijn zo oud dat ze zich niet meer delen om nieuwe cellen te maken. Ook functioneren deze ‘zombiecellen’ niet echt meer, hun processen zijn minder efficiënt en als gevolg daarvan beginnen ze schadelijke stoffen uit te scheiden.
Verschillende onderzoeksgroepen en bedrijven zetten in op het verwijderen van senescente cellen, in de hoop het verouderingsproces te remmen. Zij ontwikkelen hiervoor senolytica, medicijnen die de senescente cellen te lijf gaan. Muizen die senolytica krijgen toegediend, worden niet direct ouder dan hun onbehandelde soortgenoten, maar blijven wel langer gezond. Een langere levensduur is wel gevonden bij muizen die de behandeling pas op late leeftijd ondergingen. Dat klinkt misschien veelbelovend, maar de stap van muis naar mens is vooralsnog erg groot.
Leeg reservoir stamcellen
Een stamcel is een cel die nog kan veranderen in één of meer andere celtypes. Zo zorgen stamcellen er onder andere voor dat weefsels in je lichaam kunnen blijven vernieuwen. Naarmate je ouder wordt, neemt de hoeveelheid actieve, goedwerkende stamcellen af.
Wellicht kunnen we dit aftakelingsmechanisme te lijf door te leren van het weinig opmerkelijk uitziende wormpje Schmidtea mediterranea. Deze platworm beschikt over een bijzonder groot reservoir aan stamcellen, zogenaamde neoblasten, waarmee hij de grenzen van de eeuwige jeugd opzoekt. Met de hulp van die neoblasten kunnen de wonderwormpjes hun cellen constant vernieuwen en is in de cellen geen veroudering waarneembaar.
Ruis op de lijn
Hoe meer schade cellen door de jaren heen hebben opgelopen, hoe minder goed ze met elkaar kunnen communiceren. De onderlinge ‘berichten’, in de vorm van signaalmoleculen, bevatten specifieke boodschappen of instructies voor een cel of weefsel. Als zo’n bericht vlot en volledig op de juiste plek komt, werkt het systeem. Maar door de opgelopen schade die ons lichaam gedurende het tikken van de klok heeft opgespaard, raakt de overdracht van berichten minder efficiënt of bereiken ze hun beoogde einddoel überhaupt niet. Een neerwaartse spiraal dus: naarmate het communicatienetwerk rommeliger wordt, verlopen processen in het lichaam nóg minder goed.
Een voorbeeld van zo’n miscommunicatie is zogenaamde inflammaging, een samentrekking van de Engelse woorden voor 'ontsteking' (inflammation) en 'verouderen' (ageing). Normaliter zorgt een ontsteking bij bijvoorbeeld de infectie van een wondje ervoor dat signaalmoleculen het immuun- en reparatiesysteem aanzwengelen. Inflammaging is een ouderdomsgerelateerde, chronische ontsteking in het hele lichaam. Hoewel op een heel laag pitje, zorgt deze ontsteking en de min of meer aanhoudende aanwezigheid van deze signaalmoleculen voor ‘ruis’ in het communicatienetwerk.
Nierweefsel
iStockSleutel tot onsterfelijkheid
Een complex verhaal, maar deze oorzaken van veroudering begrijpt de wetenschap inmiddels min of meer. Betekent dat ook dat we de sleutel tot onsterfelijkheid in handen hebben, als we al deze negen pijlers in de toekomst weten ‘op te lossen’? Waarschijnlijk niet. De lijst is namelijk nog niet af: sinds de originele publicatie is het rijtje pijlers al uitgebreid tot twaalf of zelfs veertien stuks. En alle betrokken onderzoekers vermoeden dat er nog meer zullen bijkomen.
Zelfs met een volledige lijst én de tools om deze processen naar onze hand te zetten, is het nog maar de vraag of we het verouderen echt kunnen afstellen. De werking van ons lichaam is immers het resultaat van miljoenen jaren evolutie en ontzettend complex. Niemand kan precies voorspellen wat er gebeurt als je kunstmatig ingrijpt op die interacterende processen. Wie weet word je inderdaad veel ouder, maar functioneert je lichaam niet meer zoals het hoort. Dan is het ineens een stuk minder leuk om elk jaar weer een extra kaarsje uit te kunnen blazen. En blijkt 120 jaar ineens best een prima maximum.

