Medicijnen tegen hersenziekten toedienen is een probleem apart, onder meer omdat de hersenen goed afgeschermd zijn van het lichaam. Een wiskundig model kan daar verbetering in brengen.
Het menselijk brein is misschien wel het best beschermde lichaamsdeel: niet alleen zit het verpakt in een stevige schedel, maar er zit ook een soort firewall tusssen de bloedsomloop en de hersenen, de bloed-brein barrière (BBB). Er loopt weliswaar een netwerk van bloedvaten door de hersenen – net als door andere organen – maar tussen bloedvat en het hersenweefsel zit een laag cellen die alleen water, zuurstof en een paar voedingsstoffen, zoals suiker en zout, makkelijk doorlaat. Dat beschermt de hersenen in de meeste gevallen tegen schadelijke stoffen en infecties met bacteriën en virussen.
In de hersenen
De keerzijde is, dat ook veel medicijnen nauwelijks in de hersenen doordringen, te meer niet als dit medicijn uit grote moleculen bestaat. Eenmaal binnen in de hersenen, is ook nog veel onbekend over hoe een medicijn zich dan verspreidt via de extracellulaire vloeistof (ECF), het vocht waarin de hersencellen ingebed liggen.
De Leidse wiskundige Esmée Vendel promoveerde in december aan de Leidse universiteit op het ontwikkelen van een model dat dit complexe probleem in principe hanteerbaar maakt. In het model worden, behalve de bloed-breinbarrière, ook diverse compartimenten en transportmechanismes binnen de hersenen onderscheiden.
(zie afbeelding).
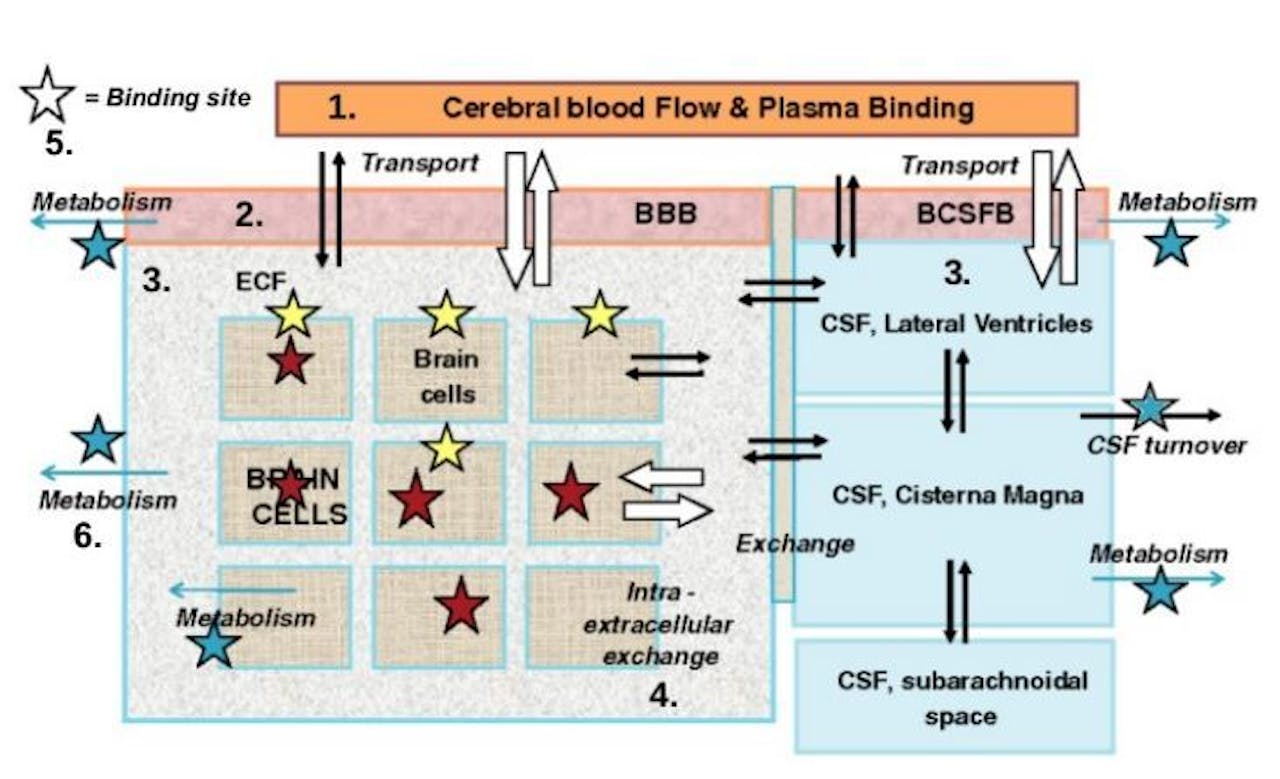
Schematische voorstelling van de hersenen in het model. Een medicijn bereikt de hersenen via bloedvaten (oranje), en moet dan door de bloed-brein barrière (BBB) heen. Eenmaal in de hersenen, verspreidt het medicijn zich via de extracellulaire vloeistof (ECF) naar de hersencellen. Daarnaast kan een medicijn ook via het ruggemerg (het rechter blok) de hersenen bereiken, al moet het dan de barrière tussen het bloed en de ruggemergsvloeistof (BCSFB) oversteken.
Tussen al deze compartimenten in de hersenen en het ruggemerg vindt passief vloeistoftransport plaats (door diffusie, zwarte pijlen), maar ook actief transport doordat cellen gericht het medicijn naar buiten of naar binnen pompen (witte pijlen). Daarnaast kunnen enzymen chemische reacties met het medicijn aangaan, waardoor het wordt omgezet in een andere stof en het medicijn zelf uit het systeem verdwijnt (blauwe pijlen).
Het medicijn kan ook chemisch gebonden raken op diverse plekken (de sterren), waar het zowel de gewenste werking, als bijwerkingen veroorzaakt.
Misverstanden
Het model beoogt de verspreiding van een medicijn in de tijd te beschrijven, en in de ruimte, dat wil zeggen: hoe het medicijn zich selectief over de diverse onderdelen van de hersenen verdeelt. Dat is belangrijk, omdat een medicijn meestal bedoeld is voor een specifieke plek in de hersenen, bijvoorbeeld een tumor. Dan wil je weten of er wel een werkzame hoeveelheid medicijn in de tumor terechtkomt, maar niet te veel daarbuiten, vanwege de bijwerkingen. De verdeling van het medicijn over de hersenen kan trouwens ook nog door de ziekte zelf worden beïnvloed.
Het model, en de doorontwikkeling ervan, zal vooral belangrijk worden voor medicijnen die nog in ontwikkeling zijn, zoals tegen Alzheimer. Deze nieuwe middelen falen vaak omdat het medicijn in onvoldoende hoeveelheden op de plek terechtkomt waar het zijn werking zou moeten uitoefenen. Vendel: “Deze problemen verschillen per medicijn. Elk medicijn heeft een iets ander doelwit in de hersenen. Verder verschilt de manier van verspreiding binnen de hersenen. Zo kan het ene medicijn bijvoorbeeld maar moeilijk vanuit het bloed over de bloed-hersenbarrière de hersenen in komen, terwijl een ander medicijn misschien wel makkelijk in het brein komt, maar eenmaal daar wordt afgebroken door bepaalde enzymen.”
Een model dat voorspelt hoe een medicijn zich door de hersenen verspreidt is mooi, maar levert dat ook behandelopties op? “Een model helpt een optimale dosering te bepalen. Dit is over het algemeen de dosering waarbij net voldoende medicijn bij het doel komt, maar waarbij de bijwerkingen minimaal zijn. Een model kan ook nog voorspellen welke manier van toediening het beste is. Direct injecteren in de hersenen gaat niet bij mensen, maar je hebt opties als: een pil, een infuus, of een injectie in het ruggenmerg.”
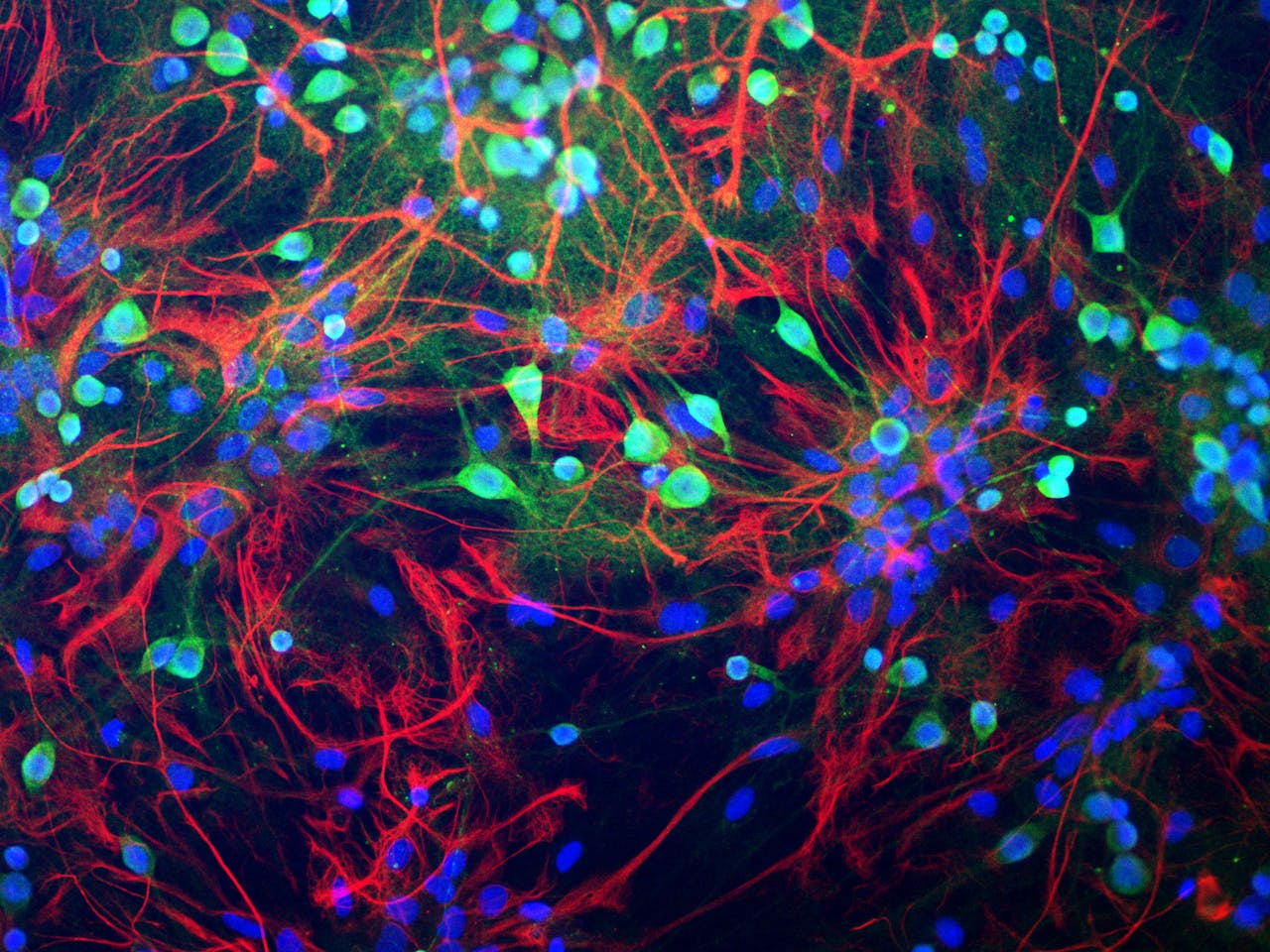
Neuronen in hersenweefsel van een rat. Sommige parameters in het model zijn nu nog ontleend aan rattenhersens, omdat ze bij mensen nog niet goed gemeten zijn.
Gerry Shaw via Wikimedia Commons CC BY SA 4.0Benaderde oplossing
Technisch gesproken bestaat het model uit een stelsel van gekoppelde partiële en gewone differentiaalvergelijkingen. Zo’n stelsel vergelijkingen is al gauw te ingewikkeld om exact op te lossen, zodat dit numeriek, door een computer, moet gebeuren. Dit houdt in dat er diverse vereenvoudigingen worden toegepast, waarna de computer stap-voor-stap een benaderde oplossing produceert. Zelfs dan is het een zeer rekenintensieve klus om dit model voor een compleet stel hersenen door te rekenen. Het model beschrijft nu een klein blokje van de hersenen.
Volgens Vendel is het volgende doel, om dit op te schalen naar een groter stuk hersenen en uiteindelijk de hele hersenen. Ook moet het model nog gevalideerd worden; er zitten nu allerlei data in het model voor de afmetingen van de bloedvaatjes, de stromingssnelheid van het bloed en de hersenvloeistof, de hoeveelheid bindingsplaatsen en dergelijke, die vooral zijn ontleend aan hersenweefsel van de rat. Bij ratten is qua experimenten veel meer toegestaan dan bij de mens.
Vendel: “Ook vooruitgang in hersenscans zou helpen, waaruit patiënt-specifieke data op dit gebied gehaald worden. Die gebruikt ons model dan om echt een voorspelling te doen voor de verdeling van een specifiek medicijn in een specifieke patiënt.”