Voor het onderzoek naar hersenziekten en geneesmiddelen daartegen zijn proefdiermodellen nodig. De groep van Matthijs Verhage in VUmc maakt muizen met epileptische aanvallen door een eiwit uit te schakelen dat betrokken is bij de signaaloverdracht in de hersenen. Neurobioloog Ruud Toonen legt uit hoe je zo’n muis met epilepsie maakt.
De muis op het filmpje loopt rustig in zijn kooi en ineens springt hij op vier poten tegelijk omhoog. De muis in de kooi ernaast ligt te slapen en lijkt plots vreemd te rillen en even later weer. Het zijn ongecontroleerde bewegingen, die lijken op epileptische aanvallen. De muizen hebben een mutatie in het eiwit MUNC18, waardoor de signaaloverdracht tussen de zenuwcellen in hun hersenen ontspoort. Het zijn proefdiermodellen voor het Ohtahara-syndroom, een vorm van epilepsie die gepaard gaat met zware mentale retardatie. Als je meer wilt weten over hoe de signaaloverdracht in de hersenen verstoord raakt door de mutatie in MUNC18, lees dan Epilepsie door weeffout in eiwit.
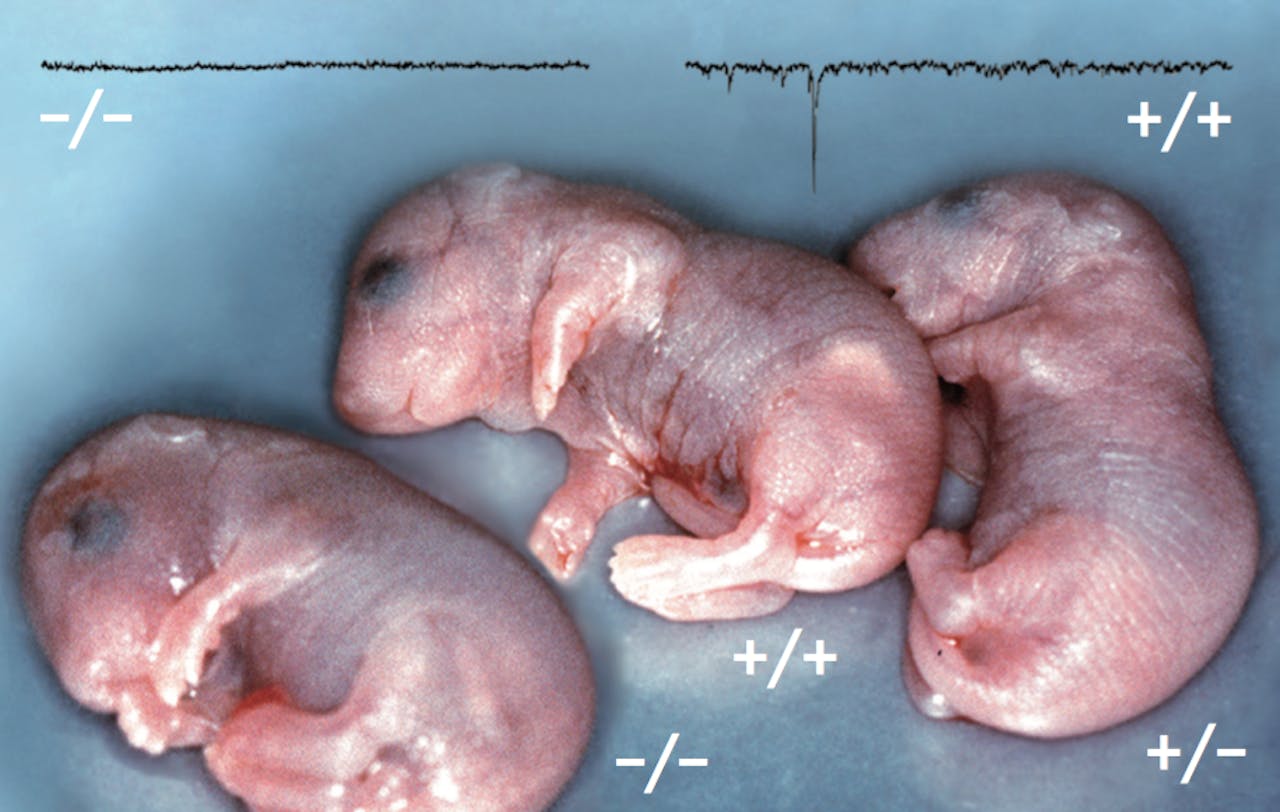
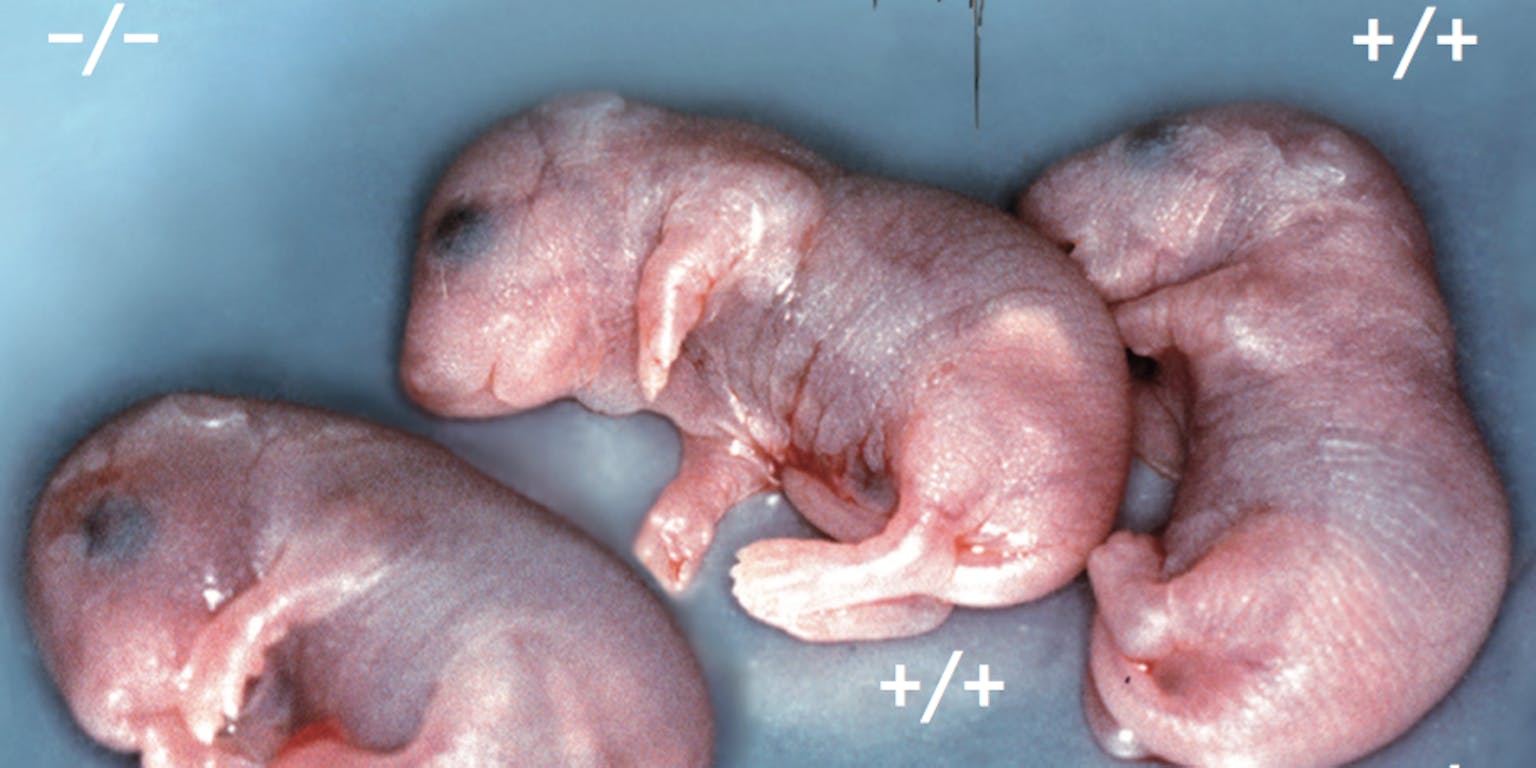
Mutante MUNC18 muizen een dag voor ze geboren zouden worden. Een hersendood jong met twee gemuteerde kopieën van het MUNC18 gen (|-), een normaal jong met twee gezonde kopieën van het gen (+|+) en een muis met epilepsie, met een gezonde en een gemuteerde kopie van MUNC18 (+|). De middelste en de rechter lijken sterk op elkaar, maar de linker ziet er een beetje anders uit: die kan niet bewegen en is hersendood. Als je een elektrode in het brein brengt, zie je dat er zonder het eiwit helemaal geen signaaloverdracht is. Dat is het bewijs dat als je het eiwit MUNC18 weghaalt, de zenuwcellen geen signalen meer kunnen overdragen.
Nonsens-gen
Voor de ontwikkeling van een geneesmiddel voor deze vorm van epilepsie is een model nodig waarin je het defect kan bestuderen, om in een latere fase zo’n medicijn op te testen. Matthijs Verhage ontwikkelde in de VS bij Thomas Südhof – die in 2013 de Nobelprijs kreeg voor zijn onderzoek naar de signaaloverdracht in hersenen – dit model voor het Ohtahara-syndroom. Een muis met epilepsie.
“Zo’n muismodel maak je met stamcellen die je uit een heel vroeg embryo haalt”, vertelt Toonen. “Die stamcellen hebben zich dan nog niet vaak gedeeld en kunnen nog uitgroeien tot het hele dier. Met DNA-technologie wordt het MUNC18-gen kapotgemaakt of vervangen door een nonsens-gen.” Met die techniek maak je een klein stukje van een gen na en je plakt er een ander stukje tussen dat de plaats inneemt van het oorspronkelijk stukje DNA. Als de cellen delen, wordt dat nonsensgedeelte mee gekopieerd.
“Dat doen we op één chromosoom, een van de twee delen van het gen – je hebt er van allebei je ouders een. Je krijgt dan embryonale stamcellen met één functionele en één niet-functionele kopie van het MUNC18-gen. Die gemuteerde embryonale stamcellen plaatsen we terug in zo’n vroeg embryo. Ze delen dan verder mee als dat uitgroeit tot een muis.”
Zwart-wit-mozaïek
Een deel van de stamcellen is dus gemanipuleerd, maar niet alles. Om ze verderop in het wordingsproces van de muis te kunnen lokaliseren, nemen de onderzoekers de stamcellen die ze manipuleren van witte muizen en injecteren ze de gemuteerde cellen in een vroeg embryo van een zwarte muis. Van de jongen die daaruit worden geboren, hebben de meeste een zwarte vacht, maar er zijn er ook die voor een deel uit zwarte en voor een deel uit witte cellen bestaan: een mozaïekmuis.
“Van deze muis zullen sommige van de ei- en zaadcellen ook de mutatie hebben en sommige niet”, legt Toonen uit. “Als je deze muis gaat kruisen en uit een van de zaadcellen met de mutatie wordt een jong geboren, dan is dat volledig wit. Dat krijgt de witte vacht mee van zijn vader. Dat jong heeft de mutatie in alle cellen op één chromosoom, afkomstig van de vader. Het van de moeder afkomstige chromosoom is normaal. De vachtkleur moet van de embryonale stamcel met de mutatie komen en die gebruik je dan als verklikker.” Dit is het muismodel voor het Ohtahara-syndroom.

Momentopnames uit een filmpje van een ‘springende’ muis met epilepsie.
Ruud ToonenHersenfilmpje
De muizen leven in kooien met bovenop een camera waarmee de onderzoekers het gedrag van de muis kunnen analyseren. Ze kunnen op afstand de onderzoekssetting veranderen en de muizen taakjes laten uitvoeren zonder ze te storen. “We hebben een testbatterij waarin we heel veel muizen tegelijkertijd kunnen observeren. We proberen zo de vertaalslag te maken van de mutaties in het genoom naar het gedrag”, legt Toonen uit.
“Wat we zien aan ‘gedrag’ is dus dat springen en trillen dat je op het filmpje ziet. Maar het is lastig om met zekerheid te zeggen dat dat epilepsie is. Want epilepsie is eigenlijk gedefinieerd met EEG’s, hersenfilmpjes, bij mensen.” Een gespecialiseerd laboratorium in Duitsland gaat binnenkort EEG’s maken bij de muizen. Dan wordt zichtbaar of ze ‘echte’ epileptische aanvallen hebben.
De volgende stap in het onderzoek is de zoektocht naar stoffen die de verstoorde signaaloverdracht kunnen herstellen. Een molecuul dat de mutatie in MUNC18 compenseert, is in potentie een medicijn. “De farmaceutische industrie en andere onderzoeksgroepen ontwerpen dit soort stoffen”, zegt Toonen: “Dat begint met een bibliotheek van wel honderdduizend moleculen. Die verzameling wordt teruggebracht tot zo’n vijftig kandidaten die we dan op zenuwcellen in een schaaltje testen om te zien hoe goed ze de signaaloverdracht beïnvloeden. Als ze die verbeteren, dan zou je de vijf meest veelbelovende kunnen testen in zo’n muismodel. Maar, dat doe je pas op het allerlaatst. Dat is eigenlijk net voordat ze op mensen worden getest.” Zie hiervoor ook: Snappen waarom een medicijn werkt