Net zoals je linker- en rechterhand elkaars spiegelbeeld zijn, hebben aminozuren – de bouwstenen van eiwitten – ook een spiegelbeeldvorm. Levende cellen hebben een voorkeur voor de ‘linker’. Maar nu is er een transporteiwit gevonden waar beide vormen in passen.

Gianluca Trinco (l) en Valentina Arkhipova, onderzoekers aan de Rijksuniversiteit Groningen, demonstreren spiegelbeeldige handen
D. Slotboom/RUG, met toestemmingDe voorkeur die het leven heeft voor één ‘hand’ is al meer dan een eeuw bekend. Veel organische moleculen bestaan in twee versies met dezelfde chemische formule en dezelfde verbindingen tussen atomen, terwijl ze qua ruimtelijke structuur elkaars spiegelbeeld zijn. In de evolutionaire geschiedenis van het leven is in sommige gevallen een voorkeur voor de L-versie ontstaan, terwijl in andere gevallen het spiegelbeeld (D-versie) de voorkeur kreeg. Dit kan een probleem zijn bij de productie van geneesmiddelen, wanneer maar één versie effectief is, terwijl de andere versie bijwerkingen veroorzaakt.
“Organismen gebruiken de L-versie van aminozuren om eiwitten te maken, maar ze gebruiken soms ook een D-versie, bijvoorbeeld in de celwand”, legt Dirk Slotboom, hoogleraar Biochemie aan de Rijksuniversiteit Groningen, uit. In het centraal zenuwstelsel van zoogdieren bevindt zich een transporteiwit voor L-glutamaat, een aminozuur dat hier dient als neurotransmitter; een stof die signalen overdraagt tussen zenuwcellen. Dit transporteiwit accepteert ook een ander aminozuur, aspartaat. “En nu blijkt dat te gelden voor zowel L-aspartaat als D-aspartaat”, zegt Slotboom.
Structuren herkennen
Die observatie van Slotboom en collega’s was verrassend. L-aminozuren zijn belangrijk voor cellen en daarom is het logisch dat transporteiwitten selectief zijn en alleen die L-vorm opnemen. Slotboom: “Een transporteiwit herkent structuren die precies passen op de bindingsplaats.” Doordat spiegelbeeldversies in ruimtelijke structuur verschillen, kan een transporteiwit het onderscheid maken. En net zoals het onmogelijk is een linkerhand in een rechterhandschoen te krijgen, zouden D-aminozuren niet moeten passen op de bindingsplaats van een transporteiwit dat is geëvolueerd om de L-versie op te nemen.
Om te ontdekken waarom dit transporteiwit wel beide vormen kan opnemen, was onderzoek nodig naar de structuur van het eiwit en naar de specifieke manier waarop dit eiwit de aminozuren transporteert. Hiervoor werd een sterk gelijkend transporteiwit uit micro-organismen gebruikt, dat een bindingsplaats bezit die bijna identiek is aan die van het zoogdier-eiwit. Het bleek dat beide vormen van aspartaat op dezelfde manier worden getransporteerd. “Daarnaast was ook de efficiëntie van het transport voor beide vormen gelijk”, zegt Gianluca Trinco die dit deel van het project voor zijn rekening nam.
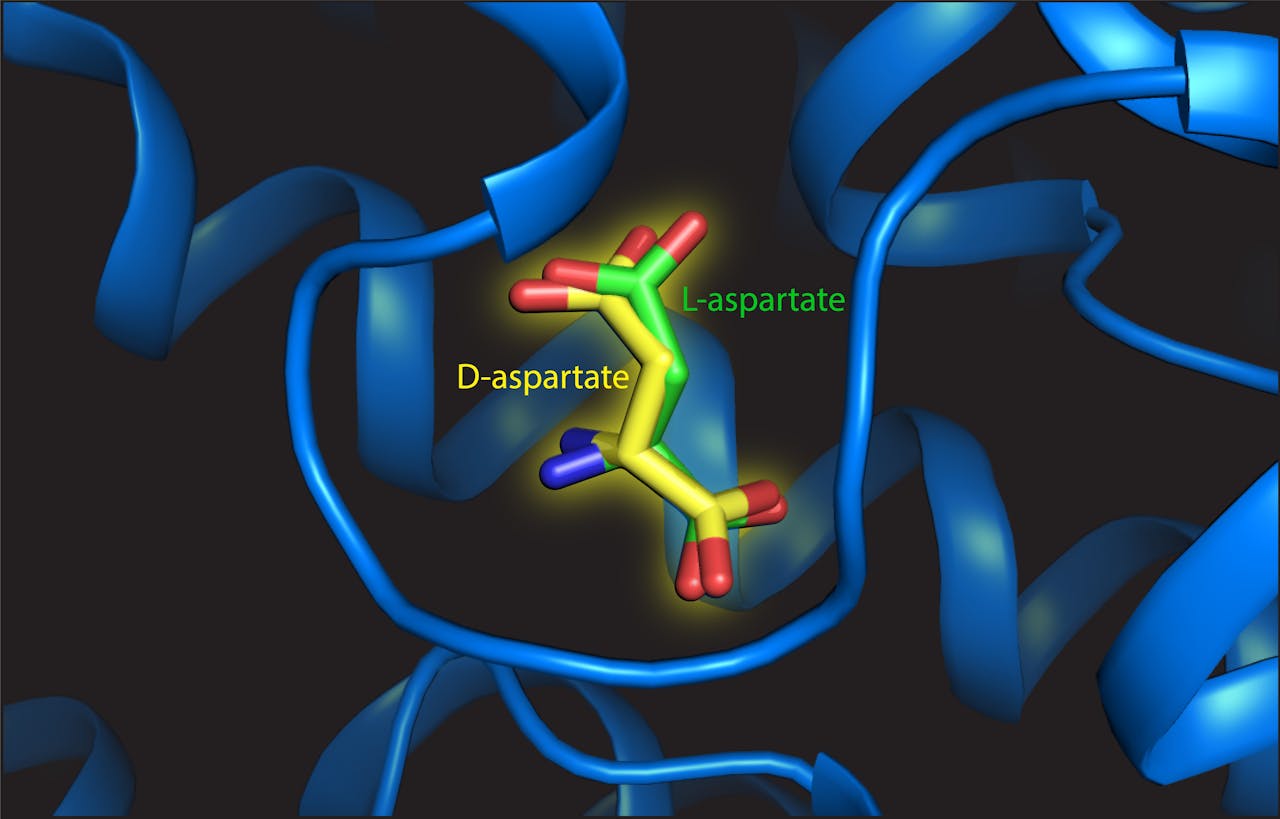
L- en D-asparaat in de bindingsplaats van het transporteiwit
V. Arkhipova/RUG, met toestemmingRuime want
Valentina Arkhipova van het Biomoleculaire Röntgenkristallografie-lab van de RUG bestudeerde de structuur van de bindingsplaats in het transporteiwit, wanneer daar L- of D-aspartaat aan vastzat. Zij zag dat D-aspartaat op die bindingsplaats paste met slechts kleine veranderingen in de structuur. “Cruciaal is dat er voldoende ruimte bleek te zijn om de afwijkende structuur van D-aspartaat te binden. Die bindingsplaats is dus niet een handschoen, maar meer een ruime want”, vertelt Arkhipova.
In micro-organismen transporteert het eiwit alleen aspartaat, dat de cellen gebruiken om eiwitten te maken, maar dat ze ook gebruiken als brandstof of als bron van stikstof. In zoogdieren transporteert het gerelateerde eiwit ook het aminozuur glutamaat. Daar speelt het aminozuur een rol als neurotransmitter in het centraal zenuwstelsel.
Er zijn aanwijzingen dat aspartaat ook kan dienen als neurotransmitter. In dat geval zouden zowel L- als D-aspartaat die rol vervullen, zegt Slotboom. “Beide typen aspartaat worden sterk gebonden, wat lijkt te wijzen op een specifieke functie. Dit suggereert dat ook D-aspartaat ergens voor wordt gebruikt.”
Interessant is dat het transporteiwit geen D-glutamaat kan opnemen. Dit lijkt een kwestie van ruimte: glutamaat heeft een extra methylgroep – een koolstofatoom met daaraan drie waterstofatomen – in vergelijking met aspartaat. “En in D-glutamaat zit die extra groep vermoedelijk in de weg zodat het niet op de bindingsplaats past.” Hier past de D-vorm dus zelfs niet in een ruime want.

