Een goede en veilige toegang tot de bloedbaan is essentieel voor nierpatiënten die moeten dialyseren. De huidige oplossingen hebben een beperkte levensduur en zorgen nogal eens voor complicaties. Nierspecialist Joris Rotmans zoekt naar nieuwe mogelijkheden voor vaattoegang, die hopelijk wel een leven lang meegaan.

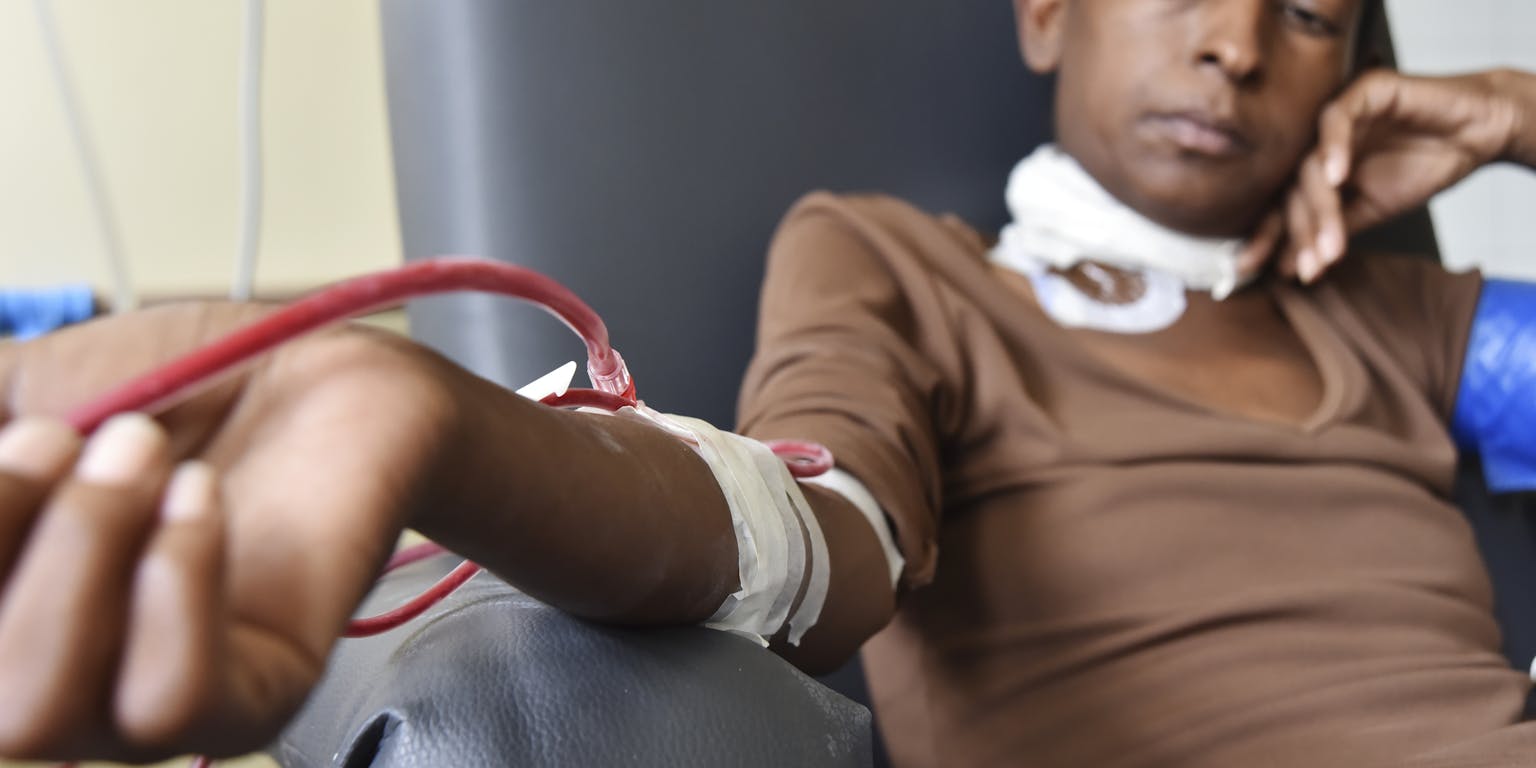
Veel nierpatiënten brengen gemiddeld twaalf uur per week door in een dialysecentrum.
Wikimedia Commons, Senado Federal via CC BY 2.0Dialyse is een levensreddende behandeling, met een grote impact op het alledaagse leven van patiënten. De meeste patiënten dialyseren een paar keer per week in een ziekenhuis of dialysecentrum. Thuis dialyseren is in veel gevallen lastig te realiseren. Je hebt er een aparte kamer voor nodig met een elektriciteitsaansluiting en een waterzuiveringssysteem. Met de ontwikkeling van de draagbare kunstnier, moet daar verandering in komen. Er is echter een probleem dat tot nu toe onoplosbaar is gebleken: hoe creëer je een ‘lifeline for a lifetime’, een goede en veilige toegang tot de bloedbaan die jarenlang meekan?
Het is het onderzoeksterrein van Joris Rotmans, internist-nefroloog aan het LUMC. Op het moment dat ik hem bel, gaat hij net weg bij een patiënt met een slecht werkende vaattoegang. “Dat is toevallig. Nu lijkt het net of ik de hele dag niets anders doe dan vaattoegangen controleren. Dat is natuurlijk niet zo, maar het is wel een groot probleem.”
Rijpe verbinding
Vervolgens legt Rotmans uit welke vormen van vaattoegang er op dit moment mogelijk zijn en welke beperkingen daaraan vastzitten. Gewone bloedvaten zijn niet geschikt voor een dialysebehandeling. Ze zijn te dun en er kan niet genoeg bloed door stromen. Daarom maken bijna alle patiënten gebruik van een shunt, een operatieve verbinding tussen een slagader en een ader. Er stroomt dan extra bloed vanuit de slagader naar de ader. Daardoor krijgt de ader een dikkere vaatwand en neemt de diameter toe. Zo kan het bloedvat makkelijker worden aangeprikt.
Bij de meeste patiënten (80 tot 85 procent) wordt de shunt gemaakt van bloedvaatjes in de arm. Zo’n lichaamseigen shunt is niet direct te gebruiken. De nieuwe verbinding moet eerst ‘rijpen’ en het duurt vaak minstens drie tot zes maanden voordat er voldoende bloed door de shunt stroomt. Vooral bij vrouwen en ouderen speelt het probleem van non-maturatie. De shunt rijpt dan niet goed en kan, bij een kwart van de patiënten, helemaal nooit voor dialyse gebruikt worden.
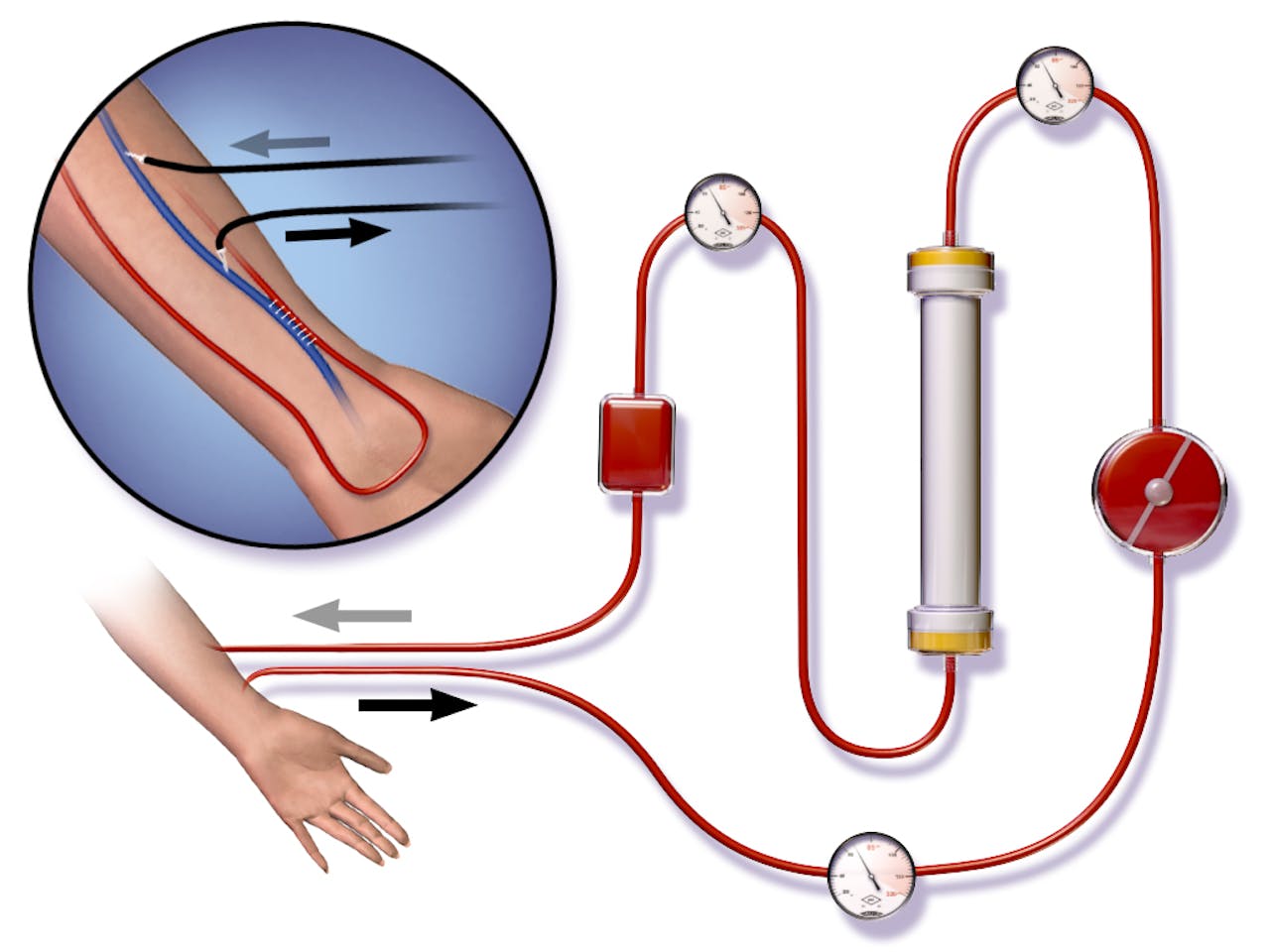
Dialyse met behulp van een shunt. In het rondje linksboven zie je hoe de shunt is aangelegd. De witte streepjes vormen een chirurgische verbinding tussen de slagader (rood) en de ader (blauw). Bij dialyse wordt de ader aangeprikt met twee naalden. Vanuit de onderste naald stroomt het bloed naar het dialyse-apparaat. Via de bovenste naald stroomt het bloed terug in het lichaam. Op de grote afbeelding kun je zien hoe de shunt is aangesloten op het dialyse-apparaat.
Wikimedia Commons, BruceBlaus via CC BY 3.0Vernauwingen en infecties
Bij sommige patiënten is het niet mogelijk om een lichaamseigen shunt aan te leggen, bijvoorbeeld als er geen geschikte bloedvaten gevonden worden. Deze patiënten (ongeveer 5 procent) krijgen een kunststof verbinding tussen slagader en ader. Zo’n kunststof verbinding is eerder te gebruiken dan een lichaamseigen shunt, maar krijgt ook sneller te maken met vernauwingen en verstoppingen. Patiënten met een kunststof shunt moeten gemiddeld twee keer per jaar een dotterbehandeling ondergaan om de vaattoegang weer open te krijgen.
Ongeveer 10 procent van de patiënten dialyseert door middel van een katheter in de hals. Een katheter wordt één keer geplaatst en hoeft tijdens de behandeling niet aangeprikt te worden. Helaas is een katheter voor de meeste patiënten slechts een tijdelijke oplossing. Er ontstaan regelmatig stolsels in de lijnen en bovendien is de kans op infecties bij het gebruik van een katheter groter dan bij gebruik van een shunt. Bij een infectie in de katheter is het risico op bloedvergiftiging groot. En bloedvergiftiging is vaak levensbedreigend.
Het onderzoek van Rotmans richt zich op de ontwikkeling van geneesmiddelen en nieuwe technieken om de kans op complicaties zoveel mogelijk te verkleinen. “We bekijken of het mogelijk is om katheters en shunts op een net iets andere manier te maken. Bijvoorbeeld van een ander materiaal, zodat er minder snel stolsels ontstaan. Of we proberen aan een lichaamseigen shunt geneesmiddelen toe te dienen die de rijping stimuleren.”
Nieuwe bloedvaten groeien
Naast verbeteringen aan de huidige vormen van vaattoegang, ontwikkelen Rotmans en zijn collega’s geheel nieuwe ideeën. Tissue engineered, oftewel in het lichaam gekweekte, bloedvaten zijn daarvan een goed voorbeeld. “We laten in het lichaam een bloedvat groeien dat meteen de juiste lengte en diameter heeft”, vertelt de nefroloog enthousiast. “Dat doen we door een kunststof staafje tussen de slagader en de ader te plaatsen. Dit staafje is lichaamsvreemd en wordt dus aangevallen door het afweersysteem. Binnen vier weken raakt het staafje helemaal omkapseld met lichaamseigen cellen. Dan halen we het staafje eruit. Wat overblijft is een weefselcapsule, een hol buisje dat we kunnen aanhechten op de slagader en de ader.”
Dit filmpje laat zien hoe de aanleg van tissue engineered bloedvaten in zijn werk gaat.
Het buisje bestaat in eerste instantie vooral uit bindweefsel. Na aansluiting op de bloedvaten gaat het weefsel differentiëren. In proefdieren was het buisje na een aantal weken veranderd in een volwaardig bloedvat. Uit mechanische testen blijkt dat het buisje heel wat druk kan weerstaan, meer dan 2000 millimeter kwik (mmHg). Dat is vele malen hoger dan de bloeddruk, die bij patiënten op maximaal 200 mmHg ligt. Of tissue engineered bloedvaten ook bij patiënten succesvol zijn, is nog even afwachten. Op korte termijn starten de eerste onderzoeken bij mensen.
Langdurig dialyseren zonder naalden is op dit moment nog niet mogelijk.
Wikimedia Commons, Dan via CC BY 2.0Dialyse zonder naalden
Met tissue engineered bloedvaten kun je een aantal problemen van de huidige shunts omzeilen. “Het grootste voordeel is dat er geen maturatie meer nodig is. Je maakt een buisje dat je direct kunt gebruiken”, zegt Rotmans. Toch erkent hij meteen dat tissue engineered bloedvaten niet de oplossing zijn voor alle problemen. “Een goede vaattoegang moet aan drie belangrijke eisen voldoen. Je moet het systeem goed kunnen gebruiken, met zo min mogelijk interventies. Het systeem moet veilig en comfortabel in gebruik zijn. Eigenlijk moet een patiënt het kunnen gebruiken zonder dat daar continu iemand bij aanwezig is. En het systeem moet patiëntvriendelijk zijn.”
Vooral op het tweede en derde punt schieten veel systemen voor vaattoegang nog tekort. Het aanprikken van een shunt is pijnlijk en er wordt ook nog weleens mis geprikt. Dat is op dit moment de belangrijkste barrière voor thuisdialyse, meent Rotmans. “We willen dit probleem aanpakken en zijn daar ook druk mee bezig, maar meer kan ik er op dit moment helaas niet over zeggen.” Over twee jaar hoopt Rotmans meer te kunnen vertellen over een dialysesysteem dat werkt zonder naalden, zodat er in de toekomst meer patiënten thuis kunnen dialyseren.