Wanneer een beschadigde lever zichzelf niet meer repareert, is transplantatie de enige optie. Maar voor de wereldwijd tientallen miljoenen mensen met leverschade zijn veel te weinig donoren beschikbaar. Hans Clevers, hoogleraar Moleculaire genetica bij het Hubrecht Instituut (KNAW), werkt aan een manier om met stamcellen minilevers te kweken die het orgaan zo goed als nieuw kunnen maken.
Reparatie met behulp van stamcellen: het idee ligt voor de hand, want stamcellen zorgen ook in gezonde mensen voor kleine reparaties aan organen. Stamcellen worden juist bij schade actief. Onderzoek naar stamcellen loopt al enkele decennia, vertelt Clevers. “De belangrijke eiwitten die tijdens de ontwikkeling in de baarmoeder een rol spelen zijn de wnt-eiwitten die signalen tussen cellen doorgeven. deze werden ontdekt in de jaren tachtig. Wij vonden dat ze cruciaal zijn voor het actief houden van volwassen stamcellen. Zijn ze overactief, dan leidt dat tot kanker.”
Oplossing voor donortekort
Clevers startte zijn stamcelonderzoek bij de darm. Dat orgaan vernieuwt zijn cellen elke vier dagen, en heeft daarmee de meest actieve stamcellen van alle organen. In 2009 slaagde de groep van Clevers erin om de darmstamcellen – twee jaar eerder ontdekt – op te kweken. Vorig jaar bewezen de onderzoekers samen met Japanse collega’s dat je die cellen kunt reorganiseren tot minidarmpjes, en die zogenoemde organoïden kunt terugplaatsen in de beschadigde darm van muizen.
Daarmee komt het ultieme doel van stamceltherapie weer een paar stappen dichterbij. Clevers: “Als je een ziek of beschadigd orgaan kunt repareren met stamcellen, zou het donortekort een veel kleiner probleem zijn. Je gebruikt het lichaam van de patiënt als het ware als ‘donor’ om het eigen weefsel te kunnen herstellen.”

Hans Clevers: “Als één gezonde cel genoeg kan zijn voor genezing, biedt een behandeling van minilevers perspectief voor miljoenen patiënten.”
Sander HeezenZelfreparerend orgaan
De behandelmethode is niet uitsluitend geschikt voor darmen, hoewel die er door het grote regeneratieve vermogen wel ideaal voor zijn. Clevers en collega’s werken ook aan een toepassing van deze methode op de lever. Er lijden wereldwijd miljoenen mensen aan chronisch leverfalen. Dat wordt veroorzaakt door een genetisch defect of door virussen, alcohol of andere giftige stoffen. Een levertransplantatie kan hen soms helpen, maar daar zijn veel te weinig donororganen voor beschikbaar. Met de methode die door de groep van Clevers binnen onderzoeksconsortium NIRM is ontwikkeld, zou een simpele injectie genoeg zijn om een hele lever te repareren.
Het bijzondere aan de lever is dat het orgaan normaal gesproken zichzelf goed kan repararen. Haal je een deel van de lever weg, dan kan het zelfs weer aangroeien. Een zieke lever is dat vermogen verloren, maar zou in theorie genoeg kunnen hebben aan een paar getransplanteerde gezonde stamcellen om zijn functie weer terug te krijgen. Dat maakt de lever – in tegenstelling tot bijvoorbeeld het hart – erg geschikt voor dit type onderzoek.
Minilevers
In januari 2015 publiceerde Clevers in het wetenschappelijke tijdschrift Cell een zogenaamd _proof of concept_-onderzoek, gebaseerd op precies dat idee. De onderzoekers haalden stamcellen uit de galgangen van een donorlever, en zetten die op kweek.
“Eerst moet je met de juiste groeifactoren miljarden cellen maken”, zegt Clevers. “Als je heel veel stamcellen en voorlopercellen hebt, kunnen die zich gaan specialiseren tot de twee belangrijkste onderdelen van de lever: hepatocyten (levercellen) en galgangcellen.” De leverorganoïden die daaruit worden gemaakt bestaan uit tienduizenden cellen en meten slechts twee tot drie millimeter, maar hebben wel een echte 3D-structuur.
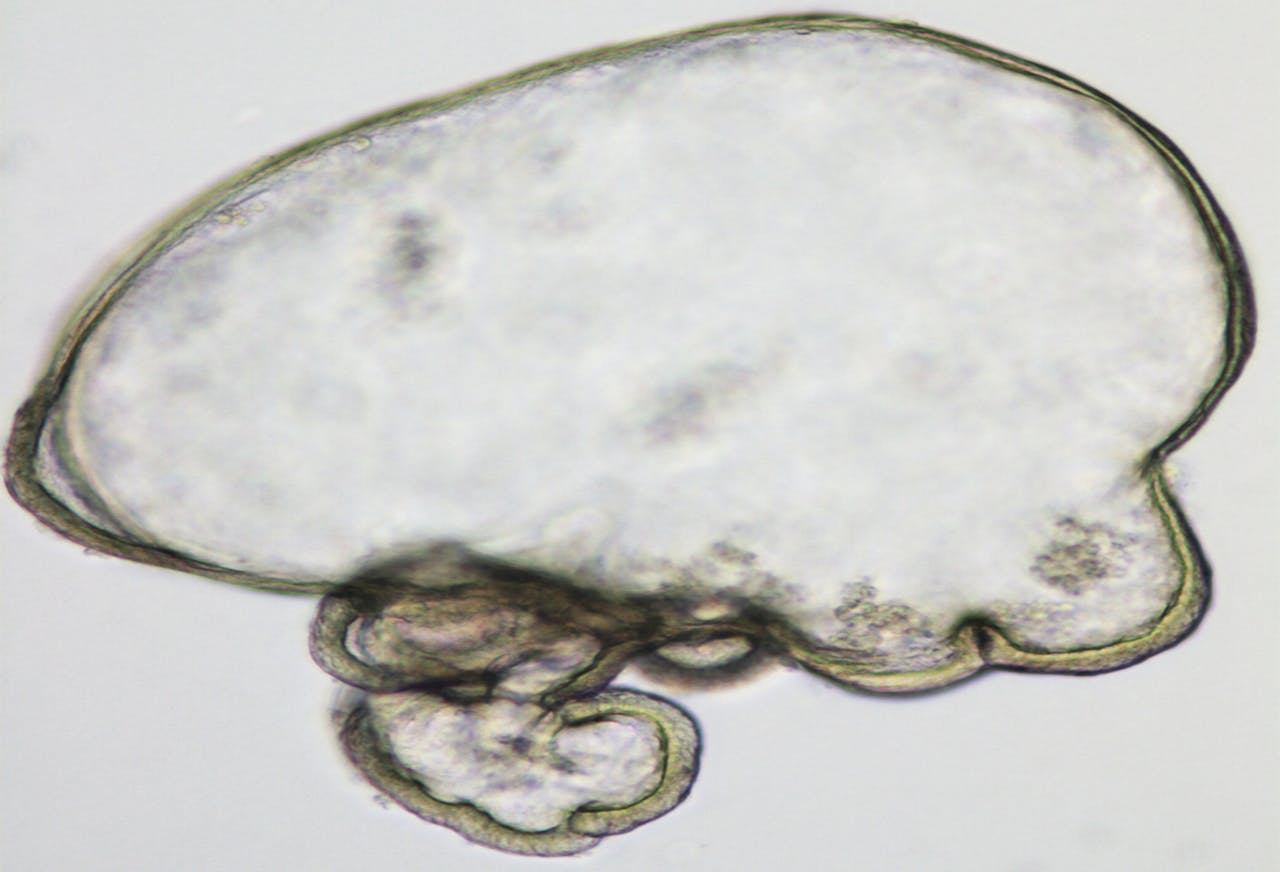
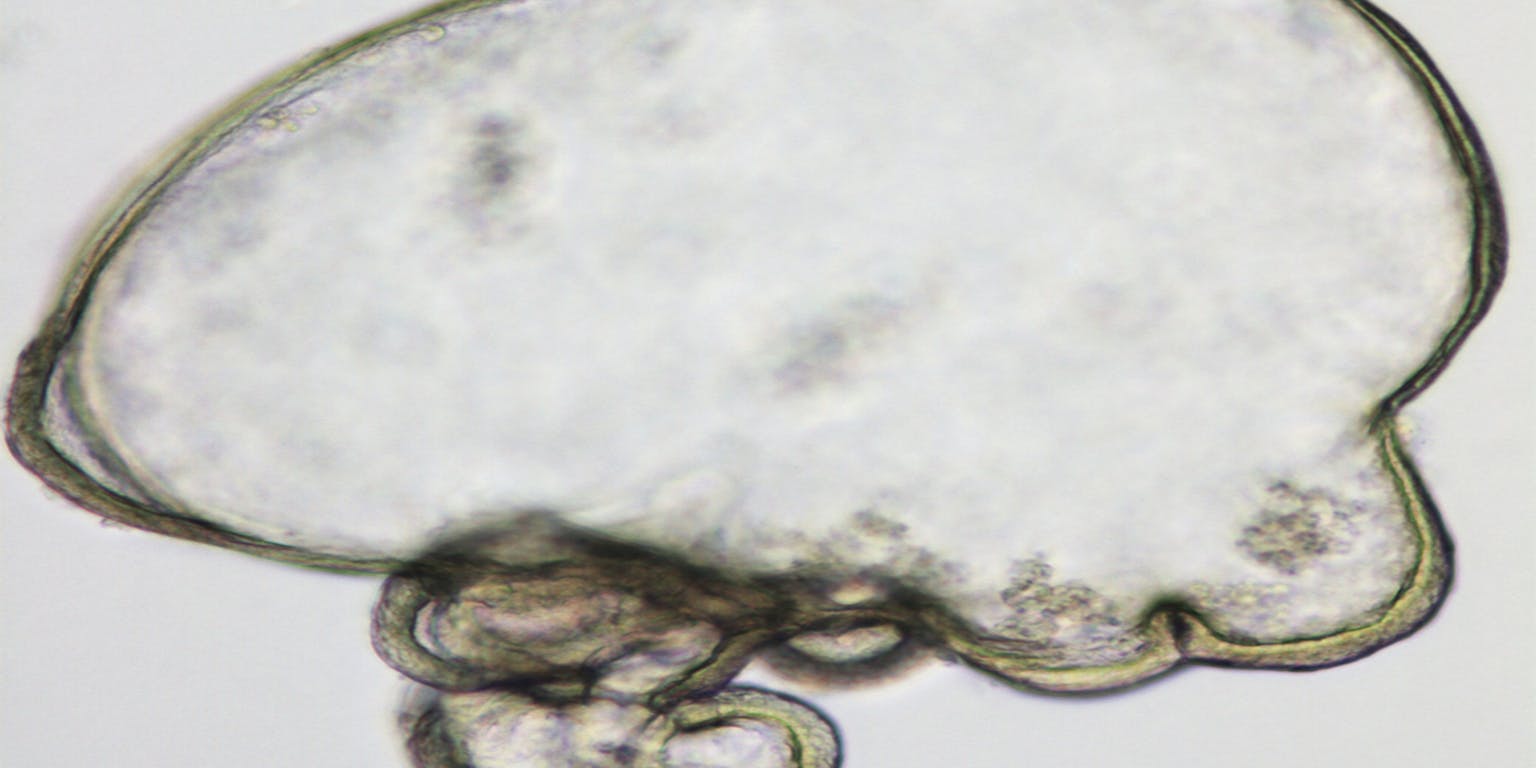
Een microscoopopname van een gekweekte leverorganoïde van muizencellen.
Meritxell HuchDie minilevers plaatsten de onderzoekers terug in muizen met leverschade en een onderdrukt immuunsysteem. Die knapten zichtbaar op: de gezonde cellen vervingen delen van de beschadigde lever. “Hoewel de leverschade bij de muizen zich sowieso op den duur wel zou herstellen, zagen we dat muizen met deze behandeling sneller opknapten”, vertelt Clevers.
Koloniseren
Bij deze stamceltherapie fungeert de zieke lever als – zoals dat in de regeneratieve geneeskunde heet – een scaffold (steiger). De infrastructuur van het beschadigde orgaan is nodig om de organoïden zich te laten hechten. Voor de lever gaat dat relatief eenvoudig: “Je kunt de organoïden in de poortader inspuiten, die bloed direct naar de lever voert. De poortader vertakt zich in zeer kleine haarvaten, zodat de organoïden daar vanzelf blijven steken. Ze koloniseren vanuit daar gemakkelijk de lever”, aldus Clevers.
Bij muizen bleek de poortader overigens te klein, dus kregen zij de minilevertjes in de milt toegediend. Toch vonden de organoïden ook vanaf daar vanzelf de weg naar de levers en konden zich daar nestelen.
Nog wat horden
De stap van proefdieronderzoek naar de mens is in dit type onderzoek groot. Er worden al wel klinische experimenten gedaan met volwassen levercellen, waarbij miljarden losse cellen via de poortader worden toegediend. Met stamcellen zou het een stuk effectiever zijn. Maar er zitten wat haken en ogen aan…
De technische kant gaat wel goed, zegt Clevers: het opschalen van de kweek, om van een paar stamcellen tot miljarden cellen te komen, is al gelukt. Het probleem ligt vooral in de regelgeving. De grootste zorg is dat er door mutaties in de organoïden kanker ontstaat in de weefsels. Volgens Clevers lijkt dat uitgesloten: “Je ziet dat niet gebeuren in de celkweek. Als je de omgeving optimaal houdt voor de cellen – dus de goede stoffen toevoegt en zorgt dat ze goed groeien – blijf je weg bij kanker. De cellen zijn genetisch zeer stabiel.”
“Het zou ideaal zijn als we patiënten op de wachtlijst voor transplantatie alvast kunnen behandelen met leverorganoïden”, vindt Clevers. “Maar daarvoor moeten we nog een aantal horden nemen.” Zo willen de onderzoekers eerst zeker weten hoeveel organoïden ze moeten toedienen voor een optimaal effect, en of dat vooral stamcellen of volgroeide cellen moeten zijn.
Clevers heeft er alle vertrouwen in dat het principe ook bij mensen werkt. “Er zijn patiënten met een leverziekte bekend, bij wie bij toeval de erfelijke afwijking in een enkele cel werd rechtgezet. Beetje bij beetje herstelde de lever zich dan vanuit die cel, en de patiënten werden gezond. Als één gezonde cel genoeg kan zijn voor genezing, biedt een behandeling van minilevers perspectief voor miljoenen patiënten.”