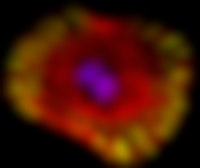
Vijf jaar geleden maakte de wereld kennis met een in het lab ontworpen en gemaakte ‘bacterie’ die werd gepresenteerd als de meest minimale vorm van leven. Voortplanten lukte nog net, maar het leverde een ratjetoe aan nakomelingen op. Dezelfde onderzoekers komen nu met een nieuwe variant. Een handvol genen erbij en het kroost ziet er weer keurig uit.
Hoe ziet ‘leven’ er in de meest minimale, uitgeklede, eenvoudige vorm uit? Wat heeft zelfs de allersimpelste cel nodig om te kunnen leven en dus te kunnen groeien en delen? Essentiële vragen voor iedereen die graag wil weten wat nou precies de basis van leven is en hoe dat eerste leven ooit kon ontstaan. Je kunt op verschillende manieren proberen deze vragen te beantwoorden: bottom-up (van onderaf) of top-down (van bovenaf).
Wetenschappers die het probleem bottom-up benaderen, beginnen bij de losse bouwstenen, zoals eiwitten, DNA en de vettige stoffen die het omhulsel van een cel vormen. Door die bouwstenen aan elkaar te koppelen tot iets grotere onderdelen en vervolgens die ook weer te combineren, proberen ze een nieuwe, levende cel te bouwen. In Nederland werken onderzoekers binnen het BaSyC (Building a Synthetic Cell)-consortium op deze manier.
Genetisch sloopwerk
Wie top-down werkt, begint juist bij een levende cel en knipt dan stapsgewijs stukken uit het DNA, waardoor allerlei onderdelen in de cel niet meer goed werken of geheel verdwijnen. Legt de cel het loodje, dan stop je die stukken DNA weer terug. Leeft de cel gewoon door, dan zijn die componenten blijkbaar niet noodzakelijk en ga je verder met het sloopwerk. Zo kom je – na heel veel puzzelen en proberen – uiteindelijk op een ‘minimale’ cel die nog net kan leven. Dit is de strategie van het Amerikaanse J Craig Venter Institute (JCVI), waarmee het al meerdere doorbraken heeft bereikt.
In 2016 publiceerden onderzoekers van het JCVI hun extreem minimale cel, genaamd JCVI-syn3.0. Deze cel, eigenlijk een in het lab ontworpen en gemaakte mini-bacterie, heeft slechts 473 genen. Ter vergelijking: de bekende poepbacterie E. coli heeft ongeveer 4.500 genen en de mens rond de 25.000. Maar met slechts 473 genen lukt het JCVI-syn3.0 ook om (heel langzaam) te groeien en te delen. Weliswaar alleen in een heel goed verzorgde omgeving met voedingsstoffen in overvloed, een constante temperatuur en geen vijanden in de buurt, maar toch. Het was een belangrijke mijlpaal. Meest opvallend was echter dat van bijna een derde van de genen in deze minimale cel onbekend is wat ze precies bijdragen. We weten niet wat de functie van die genen is, maar voor deze minimale cel zijn ze blijkbaar van levensbelang.
Rommelige voortplanting
Nu komt het JCVI-team, samen met onderzoekers van andere instituten in de VS, met een nieuwe variant: JCVI-syn3A. Een familielid van 3.0 uit 2016, met een paar nieuwe eigenschappen. En tegen de verwachting in is deze nieuwe cel niet nog minimaler, maar juist ietsje uitgebreider. Het heel minimale karakter van 3.0 gaf namelijk ook problemen. Het lukte 3.0 wel om te delen en zich zo voort te planten, maar dat ging heel erg rommelig. Bij gezonde, ‘normale’ cellen levert de celdeling twee identieke, goed werkende nieuwe cellen op die elk weer verder groeien en ook kunnen delen. Maar als 3.0 ging delen, leverde dat een verzameling heel verschillende nieuwe cellen op met allerlei vormen en in allerlei maten. Bolletjes, staafjes en sliertjes, soms nog aan elkaar geplakt en soms zelfs bolletjes zonder DNA. Wel een omhulsel, geen inhoud. Kortom, wat voortplanting betreft was 3.0 niet serieus te vergelijken met een functionele, levende cel.
De grote vraag was daarom welke genen tijdens het sloopwerk waren verdwenen die normaal gesproken zorgen voor een nette, voorspelbare en goed gereguleerde celdeling. En dus moesten de onderzoekers terug naar JCVI-syn1.0, de originele, in het lab gebouwde ‘designerbacterie’ uit 2010 waar 3.0 een minimale versie van was. Deze JCVI-syn1.0 kon namelijk wel netjes delen. Na eindeloos veel knippen, plakken en testen had onderzoeker Lijie Sun beet: een blok van negentien genen uit 1.0 was het ontbrekende stukje van de puzzel. Ze plaatste deze genen in 3.0 en zo ontstond een net iets minder minimale, maar nog steeds heel kleine, nieuwe cel: JCVI-syn3A. En deze kan wel keurig delen. Nu zijn alle nakomelingen weer nette, even grote bolletjes. Net als bij hun voorouder uit 2010.
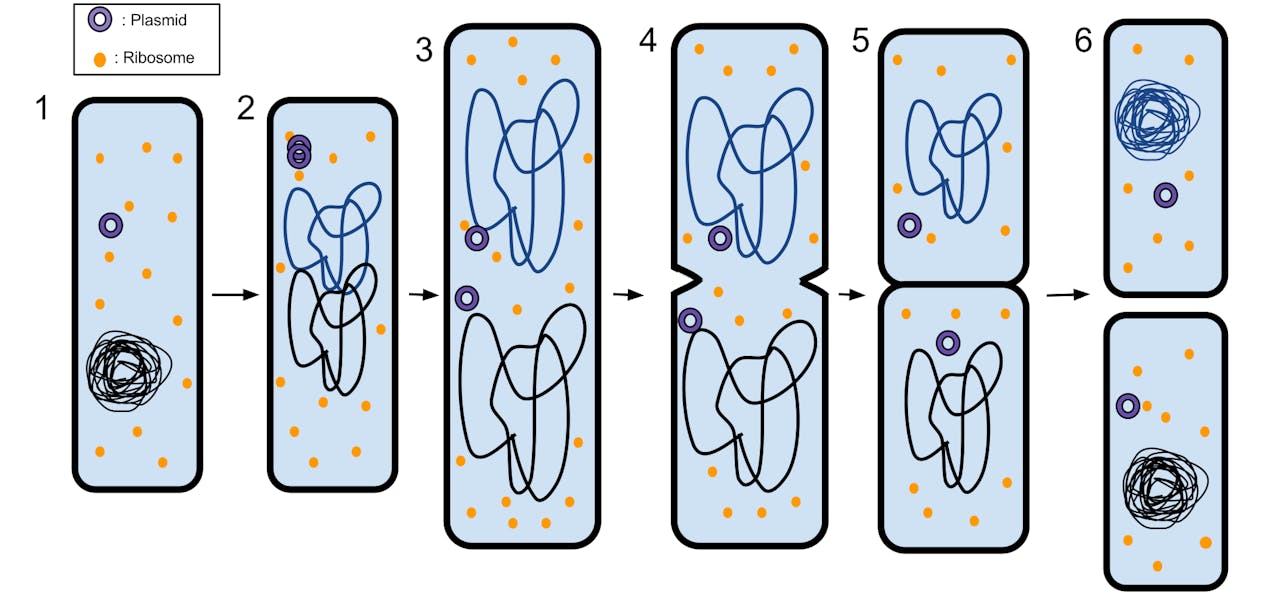
Schematische weergave van de celdeling in een bacterie. In stap 2 wordt het DNA gekopieerd en in stap 3 wordt alles netjes verdeeld. In stap 4 en 5 wordt de cel precies in het midden afgesnoerd met als resultaat twee identieke nieuwe cellen (stap 6) die op hun beurt weer gaan delen.
Ecoddington14 via Wikimedia Commons CC BY SA 3.0Functie onbekend
Van de negentien genen zijn er zeven direct betrokken bij de vorm en het uiterlijk van de nakomelingen, maar ook nu weer is het voor het grootste deel een mysterie wat die genen nou precies doen. Twee van die zeven genen zijn bekend: ze coderen voor eiwitten die in heel veel bacteriën een centrale rol spelen bij de celdeling. De andere genen coderen voor eiwitten ‘die iets te maken hebben met de celmembraan’ of voor een eiwit dat andere eiwitten in stukjes kan knippen, maar welke dat zijn, is ook weer niet duidelijk.
Wat hebben we dan aan deze nieuwe variant cel als er nog zoveel onbekend is? Van afstand bekeken lijkt het allemaal een hoop werk voor weinig resultaat. “Ik kan me voorstellen dat dat zo overkomt, maar toch zie ik dit als weer een essentiële stap in het beter begrijpen van hoe leven werkt”, zegt Bert Poolman, hoogleraar biochemie aan de Rijksuniversiteit Groningen en een van de onderzoeksleiders binnen het BaSyC-programma. “Misschien moeten we dit soort stappen nog wel honderd keer zetten om het allemaal echt te begrijpen.”
BaSyC volgt de bottom-up benadering; zij proberen van nul een levende cel te bouwen uit bestaande biologische bouwstenen. Daarvoor is het top-down onderzoek van JCVI van groot belang, aldus Poolman. “Een enorme uitdaging bij het bouwen van een synthetische cel zoals wij dat proberen, is dat je de verschillende, losse modules op een moment aan elkaar moet koppelen.” Denk bij modules bijvoorbeeld aan de onderdelen die zorgen voor de energiehuishouding, voor het kopiëren van het DNA of het produceren van bouwstenen voor de celmembraan tijdens de groei. In een levende cel werken al die processen in harmonie en zijn ze op elkaar afgestemd in ruimte en tijd. Alles moet op het juiste moment op de juiste plaats gebeuren.
“Dat is heel lastig om na te bouwen”, zegt Poolman. “Maar het werk aan JCVI-syn3.0 laat zien dat ook zonder goede timing er toch gedeeld kan worden. Slordig en ongereguleerd delen kan ook levende cellen opleveren. En nu blijkt dat een setje van slechts zeven genen genoeg is om een koppeling aan te brengen tussen de genetische informatie, de timing van de celdeling en de vorm van de nakomelingen. Dat zegt ons weer iets over hoe leven in elkaar zit. Interessant is natuurlijk om te zien welke andere genen hier een rol bij spelen, want deze zeven genen doen dat natuurlijk niet alleen. Er moet een koppeling zijn met enkele van die 473 genen die er al waren.”
Evolutie
Poolman mist ook wel zaken in dit onderzoek. “Ik vind het opvallend dat de onderzoekers geen experimenten beschrijven waarin ze naar evolutie hebben gekeken en dat ze daar ook niet op zinspelen. Dat zou ik graag willen zien: wat er gebeurt als je deze cellen heel lang blijft kweken? Ontstaat er dan selectie voor de cellen met de beste regulatie van de celdeling? In welke genen treden veranderingen op?” Evolutie heeft zeker de belangstelling van het JCVI, zo laat onderzoeksleider John Glass van het JCVI desgevraagd weten, maar die experimenten voeren ze met andere onderzoeksgroepen uit. En daar is blijkbaar nog niet veel resultaat uit voortgekomen, want afgezien van een publicatie op een zogeheten preprint-server – waar wetenschappers hun resultaten alvast publiceren, zonder dat er peer review is geweest – heeft geen van de groepen die Glass noemt, hier al over gepubliceerd.
Iets voor Poolman zelf? Er zijn contacten tussen BaSyC en het JCVI, maar daar kan hij nog niets concreets over vertellen. “Maar als ik deze cellijn in handen had, zou ik dat meteen gaan doen. Ik zou staan te popelen om met deze cellen evolutie-experimenten uit te voeren.”