Bij ongeveer zeventig procent van alle kankers worden er tijdens de celdeling fouten gemaakt in de chromosoomsplitsing. Een gezonde cel zou hieraan doodgaan, maar voor een kankercel zijn die fouten gek genoeg voordelig. Celbioloog Geert Kops onderzoekt wat er precies fout gaat en hoopt een therapie te ontwikkelen die kankercellen over de rand van de afgrond kan duwen.
Tijdens de celdeling worden alle chromosomen van de moedercel eerst gekopieerd en vervolgens verdeeld over twee dochtercellen. Trekdraden (microtubuli) trekken de kopieën uit elkaar waardoor iedere cel netjes één kopie van elk chromosoom krijgt. Als er tijdens de voorbereidingen voor deze chromosoomsplitsing iets fout gaat, treden er correctiemechanismen in werking en wordt de celdeling stopgezet.
Tenminste, bij gezonde cellen. Kankercellen trekken zich van een verkeerde chromosoomsplitsing niks aan en gaan gewoon door met delen. Kops onderzoekt chromosoomsplitsing, zowel in gezonde cellen als in kankercellen.
Hoe kan het dat een kankercel zich niets aantrekt van een verkeerde chromosoomsplitsing?
“Voor kankercellen is het een voordeel om tijdens de celdeling foutjes te maken. Dat stelt ze namelijk in staat om snel het genoom te shuffelen en daardoor kunnen ze gemakkelijk nieuwe eigenschappen oppikken. Je kunt kanker zien als evolutie op een korte tijdschaal.”
“Stel: bij een eerste chemokuur gaan de meeste kankercellen dood, maar enkele hebben het juiste geshuffelde genoom waardoor zij niet gevoelig blijken te zijn voor de therapie. Deze cellen overleven en geven de resistentie door aan hun nakomelingen. Daardoor kan, soms jaren later, de kanker weer terugkeren. In agressievere vorm.”
Gezonde cellen gaan dood als ze foutjes maken. Waarom geldt dat voor kankercellen niet?
“Op de chromosomen liggen genen die coderen voor eiwitten. Eiwitten werken vaak met elkaar samen in complexen. Als één van de eiwitten uit zo’n complex in overvloed wordt geproduceerd, vindt het geen bindingspartner en gaat het rondzweven in de cel. Die rondzwevende eiwitten worden wel opgeruimd, maar dat is hard werken voor de cel waardoor hij langzamer groeit en minder gezond is.”
“In dat geval is er sprake van eiwit toxiciteit. Er ontstaat een stressreactie waardoor een gezonde cel in een soort coma raakt of zelfs doodgaat. Bij kankercellen blijft deze stressreactie uit. Dat heeft te maken met mutaties in bijvoorbeeld p53. p53 speelt een belangrijke rol bij allerlei stressreacties en als dat systeem niet goed werkt, worden foutjes in de chromosoomsplitsing makkelijker getolereerd.”
En hoe kun je daar in een therapie gebruik van maken?
“Voor een therapie tegen kanker kun je twee kanten op denken. Je zou de fouten kunnen repareren en ervoor zorgen dat de chromosoomsplitsing van kankercellen weer goed gaat. Maar dat corrigeren is waarschijnlijk erg ingewikkeld. Daarom willen wij dit anders aanpakken. Kankercellen maken foutjes waar ze voordeel bij hebben, maar zorgen wel dat ze niet zoveel fouten maken dat ze er aan onderdoor gaan. Anders gezegd, een kankercel loopt eigenlijk voortdurend op de rand van de afgrond.”
Dus is het ook mogelijk zo’n cel over de rand van de afgrond te duwen?
“Dat zijn we nu aan het onderzoeken. Op bijna elk chromosoom liggen wel genen die van groot belang zijn, bijvoorbeeld voor de aanmaak van bouwstenen of voor de energieproductie. Die genen heeft een kankercel ook nodig. Ons idee is om ervoor te zorgen dat kankercellen tijdens de celdeling een hele hoop fouten gaan maken, waardoor ze doodgaan. We weten nu min of meer welke eiwitten er een rol spelen bij het controleren van de celdeling. In samenwerking met het NKI (Nederlands Kanker Instituut, red.) ontwikkelen en testen we remmers voor deze eiwitten.”
Maar is zo’n behandeling niet gevaarlijk voor gezonde cellen?
“We denken van niet, omdat gezonde cellen beschikken over intacte controlemechanismen. Zij kunnen de gemaakte fouten dus herstellen en er op die manier goed mee omgaan.”
Hoe lang duurt het nog voordat er een therapie op de plank ligt?
“Dat is heel lastig te zeggen. We hopen dat het onderzoek dat we nu doen leidt tot klinische tests bij mensen, maar we weten ook dat een heleboel ideeën die in het laboratorium goed leken te werken uiteindelijk toch afvallen op de lange weg naar een therapie voor mensen. En zelfs als het tot klinische tests komt, kan het nog makkelijk vijf jaar duren voordat patiënten er echt iets aan zouden kunnen hebben.”
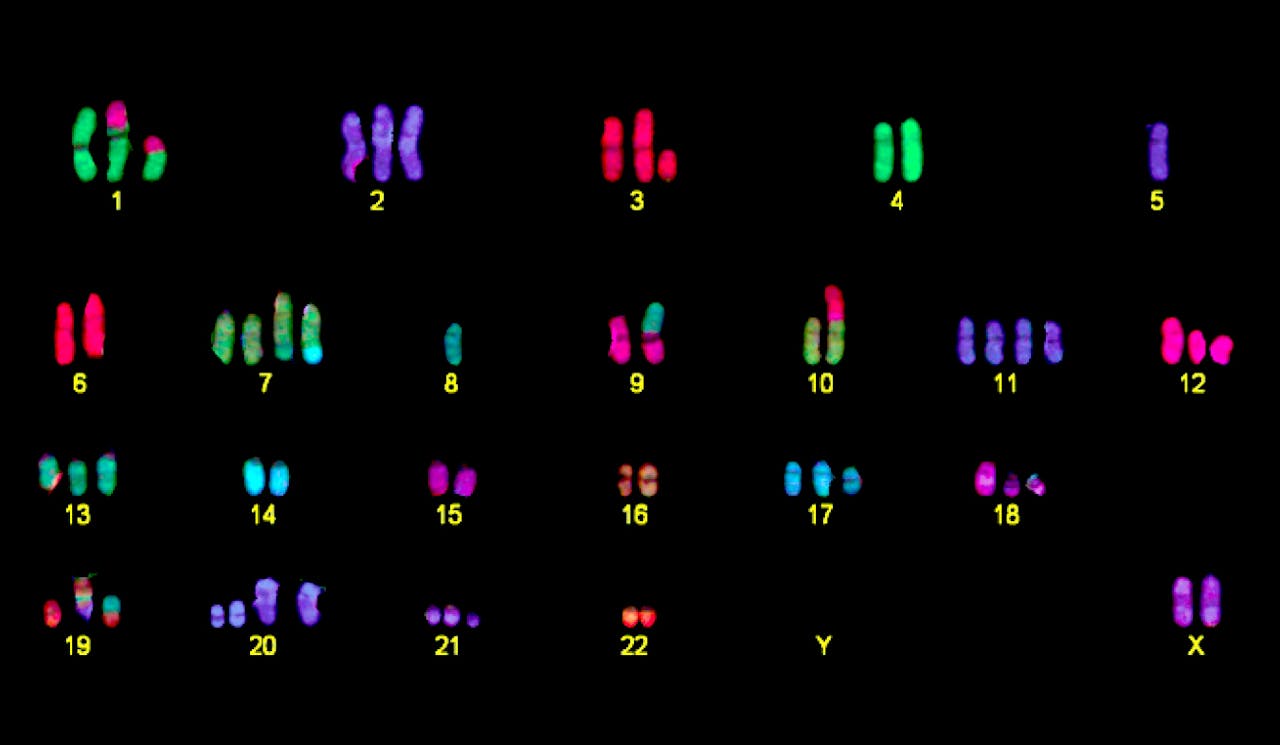
Het genoom van een kankercel, waarbij ieder chromosoom zijn eigen kleurtje heeft. Een gezonde cel heeft van elk chromosoom twee kopieën (een van papa en een van mama). Deze kankercel heeft niet alleen een afwijkend aantal chromosomen, maar sommige chromosomen bevatten verschillende kleuren. Dat betekent dat er stukken van een ander chromosoom aan zijn vast geplakt.
Janssen et al., Science 333, 1895-8 (2011)Dat is dus nog verre toekomstmuziek. Wat kunnen we verder nog verwachten van het kankeronderzoek?
“Er komt steeds meer aandacht voor therapie-op-maat, iets wat de overlevingskansen van kankerpatiënten aanzienlijk zou kunnen verbeteren. Daarom wordt er op dit moment veel geld uitgegeven om te onderzoeken of het mogelijk is van elke afzonderlijke tumor de genetische afwijkingen te bepalen. Eén van de projecten, waar ik zelf ook aan meewerk, is cancergenomicsNL.”
“Met behulp van cellen uit het biopt van een patiënt kun je in het laboratorium minitumoren laten groeien. Die kun je vervolgens genetisch onderzoeken of er therapieën op testen. Op dit moment zitten we nog in de testfase, maar we willen uiteindelijk naar een systeem waarbij we binnen een paar weken een minitumor van een patiënt hebben groeien en dan kunnen bepalen welke behandeling goed zal aanslaan.”
Zie ook:
http://www.youtube.com/watch?v=N4TYWETJUkU
Video-interview met Geert Kops (geproduceerd door Universiteit Utrecht)

