De snelheid waarmee enzymen chemische reacties uitvoeren is jaloersmakend. Gerard Roelfes probeert dat te evenaren door compleet nieuwe enzymen te ontwerpen met bouwstenen die in de natuur niet voorkomen. Dat leverde hem onlangs een grote subsidie op.
Haastige spoed is zelden goed, tenzij het gaat om chemische reacties. Dan is sneller vaak wel beter, want hoe sneller die reacties verlopen, hoe eerder je eindproduct klaar is en hoe minder energie het kost. In de chemische industrie, maar ook in universitaire laboratoria spelen daarom katalysatoren een grote rol. Dat zijn stoffen die een reactie versnellen, maar zelf niet meereageren. Ze kunnen dit kunstje daarom vele malen achter elkaar uitvoeren.
Ook ons lichaam, en alles wat leeft, kan niet zonder katalyse. Daarvoor is een speciale groep eiwitten verantwoordelijk: de enzymen. En die zijn jaloersmakend goed in hun vak. Zo goed, dat chemici zoals Gerard Roelfes, hoogleraar biomoleculaire chemie en katalyse aan de Rijksuniversiteit Groningen, in hun onderzoek enzymen als voorbeeld nemen.
Veel onderzoekers gebruiken bestaande enzymen als uitgangspunt, maar Roelfes doet het anders. Hij begint met ‘gewone’ eiwitten en gebruikt vervolgens niet-natuurlijke bouwstenen om zo compleet nieuwe enzymen te maken die de natuur niet kent. NEMO Kennislink sprak Roelfes over zijn ongebruikelijke aanpak, waarvoor hij onlangs een Europese onderzoekssubsidie van maar liefst 2,5 miljoen euro kreeg.
Jouw achtergrond is de ‘klassieke’ organische chemie: in het lab nieuwe moleculen maken. Dat is ver weg van de natuurlijke wereld van de enzymen. Waarom heb je die stap gezet?
“In de organische chemie draait het inderdaad vooral om het maken van nieuwe stoffen en de truc is dan om dat heel snel en heel selectief te doen. Met dat laatste bedoel ik dat een reactie zo min mogelijk ongewenste bijproducten oplevert. Om snel en ‘schoon’ iets te maken heb je eigenlijk altijd een katalysator nodig. Dat je met de juiste katalysator een reactie zo enorm kunt versnellen, dat heeft me altijd gefascineerd.
In het begin van mijn onderzoeksloopbaan werkte ik met de gebruikelijke katalysatoren: kleine moleculen die een metaal bevatten. Daar kun je heel interessante dingen mee doen en ze werken ook goed, maar toch kreeg ik gaandeweg het gevoel dat het veel sneller en efficiënter zou moeten kunnen. Dan kom je al snel bij enzymen, want die werken ongelooflijk snel en selectief. We zijn toen eerst het actieve deel, de zogeheten active site, van enzymen gaan nabouwen. Enzymen zijn grote moleculen die op een ingewikkelde manier opgevouwen zijn. Slechts een klein stukje van een enzym is betrokken bij de feitelijke katalyse. Het namaken van die active site leverde wel een snellere katalysator op, maar vergeleken met het complete enzym, dat makkelijk duizenden keer sneller werkte, stelde het weinig voor. Het was voor mij duidelijk dat het om méér draait dan alleen dat actieve gedeelte; je hebt ook de complete omgeving van een enzym nodig.”
Zijn enzymen daarom zo groot en ingewikkeld geworden gedurende de evolutie? Om steeds beter te katalyseren?
“Ja, dat denk ik wel. Een enzym is veel minder simplistisch dan wij het benaderen, het is niet een active site met een hoop ballast eromheen. Doordat een enzym een eigen complexe ruimtelijke omgeving creëert kan het heel veel verschillende, kleine interacties aangaan met andere moleculen en met het substraat [het molecuul dat de reactie ondergaat, red.]. Al die kleine interacties zorgen samen voor een gigantisch effect. De active site kan zorgen dat een reactie duizend keer sneller verloopt, maar in het complete enzym verloopt het, in sommige gevallen, nog weer een miljard keer sneller. Een ongekend verschil. Je hebt echt de combinatie van active site en die mooi geboetseerde omgeving nodig. Dat brengt ons bij de kern van het probleem: hoe ontwerp je de juiste ruimtelijke omgeving? Daar zit de grote uitdaging.”
Waar begin je?
“We beginnen niet vanaf nul, want er zijn simpelweg te veel mogelijkheden. Bedenk dat een klein enzym al snel uit tweehonderd aminozuren bestaat, dat zijn de losse bouwstenen die aan elkaar zijn gekoppeld in een lange streng. In de natuur zijn twintig verschillende aminozuren beschikbaar. Als je alle denkbare combinaties wilt proberen, kom je op een onvoorstelbaar groot aantal mogelijkheden uit, namelijk twintig tot de macht tweehonderd. Dat gaat dus niet. Je moet een startpunt kiezen en vanuit daar gaan veranderen en verbeteren.”
En dat startpunt is voor veel wetenschappers een bestaand enzym dat ze willen aanpassen, maar dat doe jij niet. Waarom niet?
“Omdat een enzym al is geëvolueerd voor die ene, specifieke activiteit. Als je dat wilt veranderen, moet je in feite alles wat de evolutie heeft ingebracht weer weghalen en dan vanuit een basisactiviteit opnieuw beginnen. Wij kijken vanuit de chemie, welk type reactie willen we uitvoeren en welke katalysator hebben we daarvoor nodig. Dat is onze basisactiviteit waar we mee beginnen en dat bouwen we dan in een bestaand eiwit. Niet in een enzym, maar in een eiwit dat van zichzelf geen reactie katalyseert. Dat eiwit levert dan de benodigde ruimtelijke omgeving, die we vervolgens via gestuurde evolutie verder kunnen verbeteren.”
Maar hoe kies je dat eiwit? Daar zijn er in de natuur ook ontzettend veel van.
“Nou, het aantal eiwitten dat hiervoor geschikt is valt echt wel te overzien.”
Oh? Waar selecteer je dan op?
“Er moet genoeg ruimte zijn om de active site in te bouwen en ook om de reactie met het substraat uit te voeren. Dat vraagt een vrij grote holte in de structuur, wat lang niet alle eiwitten hebben. Daarnaast moet het eiwit ook evolueerbaar zijn. We brengen veel mutaties aan [veranderingen in de genetische code, red.] en daar moet het eiwit wel tegen kunnen. Lang niet alle eiwitten zijn robuust genoeg. Als laatste moet het voldoende flexibiliteit hebben in de structuur, zodat het geheel zich kan aanpassen aan wat je nodig hebt voor de gewenste reactie. Ook dat is niet vanzelfsprekend. Al met al is de groep eiwitten die hiervoor geschikt is, helemaal niet zo groot.”
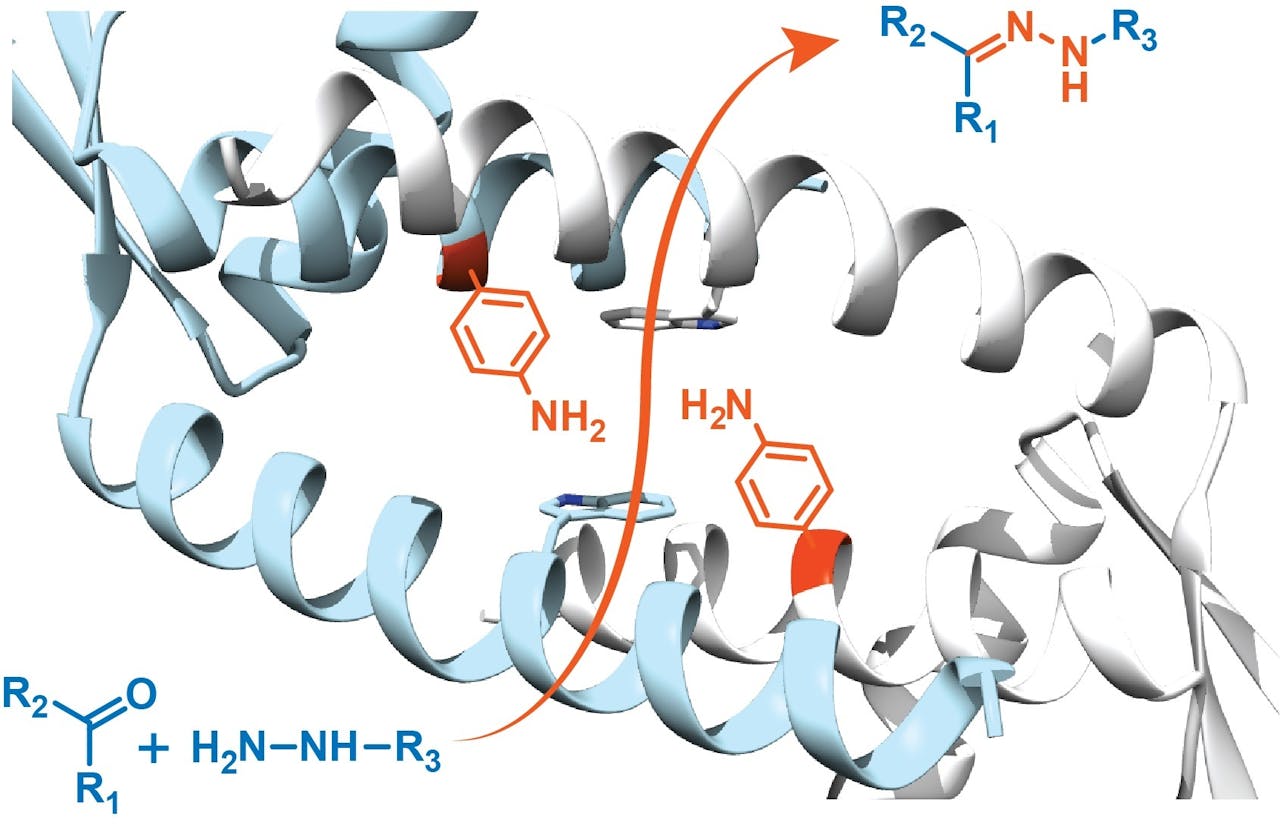
Het eerste enzym dat de groep van Roelfes ontwierp met niet-natuurlijke aminozuren (de rode structuren in de holte) als katalysator.
Clemens Mayer, RuG via EurekAlert.orgWerk je met meerdere eiwitten uit die selecte groep of heb je een favoriet?
“Onze favoriete groep eiwitten zijn zogeheten transcriptiefactoren uit bacteriën. En dan specifiek de transcriptiefactoren die zijn betrokken bij antibioticaresistentie. Deze eiwitten zijn gebonden aan het DNA van de bacterie en zodra een vreemde stof, bijvoorbeeld een antibioticum, de bacterie binnenkomt, valt de transcriptiefactor van het DNA en bindt aan het vreemde molecuul. Daardoor komt een stukje DNA vrij om ‘afgelezen’ te worden en dat zorgt voor de productie van stoffen die helpen bij de verdediging van de bacterie. Wat transcriptiefactoren voor ons interessant maakt, is dat ze veel verschillende moleculen kunnen herkennen en eraan kunnen binden. Ze hebben ook een geschikte holte daarvoor en ze zijn niet kieskeurig, waardoor ze breed inzetbaar zijn. En omdat ze niet zo specifiek werken, zijn er veel mogelijkheden voor verfijning en aanpassing. Ik zie ze als een leeg doek, dat je nog helemaal kunt beschilderen zoals je wilt.”
Dat is dan het ‘omhulsel’ waar de eigenlijke katalysator ingebouwd wordt. Waar komt die vandaan?
“De katalysator wordt gevormd door de zijketens van enkele niet-natuurlijke aminozuren die we inbouwen. We vervangen een paar bestaande aminozuren in het eiwit door niet-natuurlijke varianten die de gewenste katalytische activiteit vertonen. Bijvoorbeeld omdat ze een bepaalde chemische structuur hebben, zoals een ringvormig deel of doordat ze een specifiek metaal kunnen binden dat nodig is voor de katalyse.”
We blijven op dezelfde vraag terugkomen, maar hoe kies je die dan? Want je kunt weer oneindig veel verschillende aminozuren bedenken.
“Klopt, maar daar zijn we heel pragmatisch in. Om zo’n niet-natuurlijk aminozuur te gebruiken moet er wel een genetische code beschikbaar zijn die je kunt invoegen in het DNA dat je gebruikt om het eiwit te maken. Dat gaan we niet zelf ontwikkelen. Er zijn nu ongeveer tweehonderd niet-natuurlijke aminozuren met een genetisch inbouwpakket ontwikkeld en de meeste daarvan werken niet als katalysator. We gaan uit van wat er is en kijken dan wat we daarmee kunnen.”
Je zei eerder dat je ook gestuurde evolutie gebruikt om je nieuw-gemaakte ‘enzym’ verder te verbeteren, maar hoe werkt dat als je ook niet-natuurlijke bouwstenen gebruikt?
“Je evolueert alleen het eiwitdeel, het katalytische deel verandert niet meer. Dat is een keuze waar je aan vastzit.”
Levert zo’n evolutietraject nog veel op?
“Ja, dat is echt wel de moeite waard. In 2018 publiceerden we het eerste resultaat van onze aanpak. Toen hebben we een aniline, dat ook los al werkt als katalysator, ingebouwd in een eiwit en dat leverde meteen een honderd keer snellere reactie op. Vervolgens hebben we het eiwit via gestuurde evolutie aangepast en toen ging de reactie 26 duizend keer sneller. Dat is toch een behoorlijke stap, zeker als je weet dat het maar een beperkt experiment was met slechts drie evolutierondes. Ik weet zeker dat het nog veel sneller kan. Als je zo snel al van honderd naar tienduizend keer sneller gaat, moet je nog wel meer kunnen bereiken.”
Desondanks is het natuurlijk wel een behoorlijk omslachtig traject om tot een nieuwe of betere katalysator te komen. In hoeverre kan jullie aanpak bijdragen aan praktisch inzetbare katalysatoren?
Bladgroenkorrels waar fotosynthese plaatsvindt, het proces waarmee planten CO2 uit de lucht omzetten in nuttige bouwstenen en zuurstof.
Kristian Peters via Wikimedia Commons CC BY-SA 3.0“Mijn doel is niet zozeer om specifieke katalysatoren voor specifieke processen te ontwikkelen, maar meer om een collectie algemeen inzetbare enzymen te maken die geschikt zijn voor een bepaald type reactie en waarmee andere wetenschappers of onderzoekers bij bedrijven zelf aan de slag gaan om dat helemaal te optimaliseren voor hun specifieke proces. De grootste kansen zie ik voor veelgebruikte reacties die nu moeilijk te versnellen zijn. Een goed voorbeeld is de vorming van amidebindingen. Dat is interessant voor de farmaceutische industrie, omdat het overgrote deel van de geneesmiddelen een amidebinding bevat. Maar die reacties zijn nu nog heel inefficiënt en leveren veel afval op. Als wij een basisenzym hiervoor kunnen ontwikkelen, is dat heel interessant voor de industrie.”
Zie je nog heel andere mogelijkheden, naast het verbeteren van bestaande processen?
“Als het lukt om compleet nieuwe katalysatoren te maken, kunnen we misschien ook stoffen gebruiken die we nu als niet-reactief beschouwen. Dan creëer je eigenlijk nieuwe grondstoffen. Zoals koolstofdioxide, CO2. Dat is verschrikkelijk stabiel en geldt daarom als niet-reactief, maar stel nou dat je met de juiste katalysator dit wel als bouwsteen kunt gebruiken? Een enzym dat CO2 kan activeren zodat je het als grondstof kunt inzetten, dat zou geweldig zijn. En het moet kunnen, want tijdens de fotosynthese in planten gebeurt dat wel. De enzymen uit dat proces zijn niet makkelijk aan te passen, maar wie weet lukt het met onze manier wel om hiervoor compleet nieuwe enzymen te ontwikkelen.”

