Je drinkt er water uit en kijkt erdoor naar buiten: glas. Het is een alledaags materiaal. Toch is glas raadselachtig, want het is stevig terwijl het op het allerkleinste niveau sprekend lijkt op een vloeistof. Wetenschappers van de Technische Universiteit Eindhoven proberen dit te verklaren.
Doorschijnend, hard en mooi. We gebruiken de bijzondere eigenschappen van glas al duizenden jaren. Het duikt overal op in de geschiedenis. Als snijgereedschap in de steentijd, als versiering van aardewerk in het Oude Egypte of als Romeinse bekers en borden. Het is daarom misschien vreemd dat wetenschappers hun tanden nog steeds stukbijten op het materiaal. Geen theorie is in staat om het moment van glaswording op het niveau van moleculen goed te beschrijven.
Er is iets merkwaardigs aan de hand met de manier waarop deeltjes zijn geordend in een glasachtig materiaal. Dat heeft veel weg van de rangschikking in een vloeistof (of eerder een gebrek aan rangschikking). Toch is de verzameling deeltjes rigide, het is een vloeistof die niet meer vloeit.
Wetenschappers van onder andere de Technische Universiteit Eindhoven proberen een algemene theorie te formuleren die beschrijft hoe een vloeistof overgaat in een glasachtig materiaal. En hoe het zich op moleculair niveau als een vloeistof vermomt. Die zoektocht blijkt onverwachte toepassingen te hebben in bijvoorbeeld het onderzoek naar het uitzaaien van tumoren.
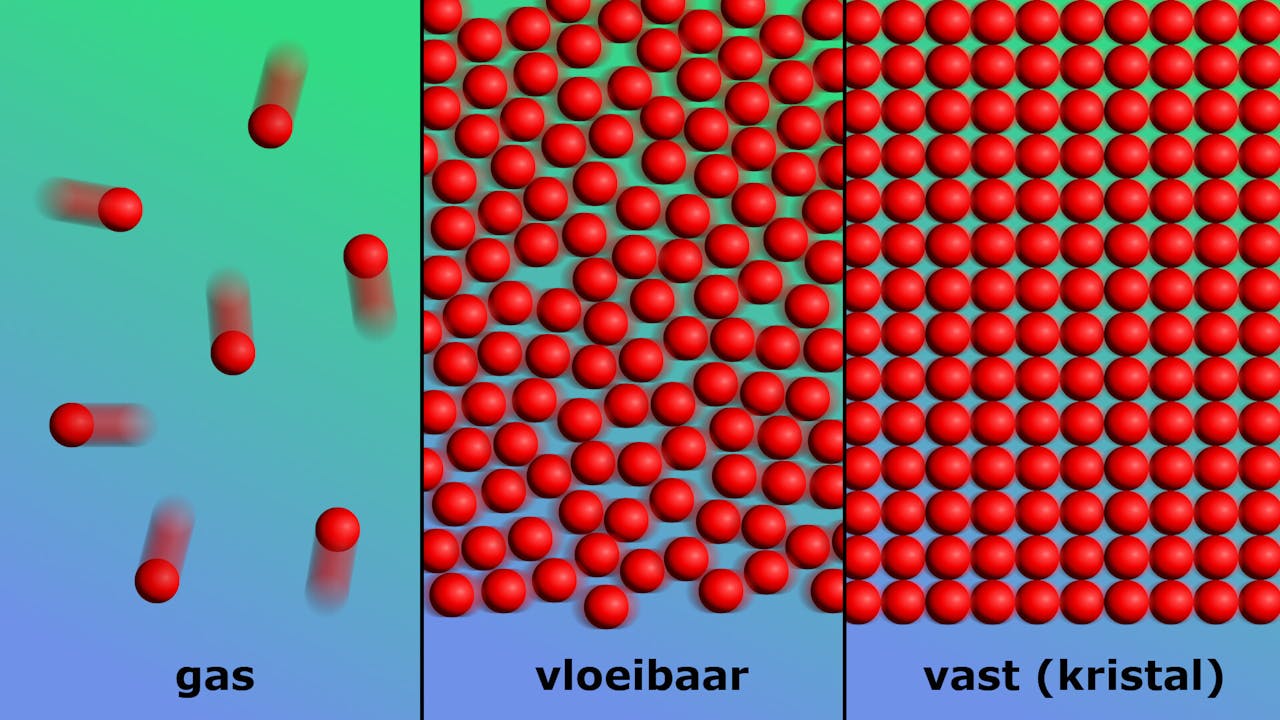
Ordening van de deeltjes in een gas, vloeistof of vaste stof. In een gas raken de deeltjes zoals atomen en moleculen elkaar niet aan en zijn volledig vrij om te bewegen, ze kunnen wel botsen. In een vloeistof zitten de deeltjes tegen elkaar aan maar zijn wel mobiel. De vaste fase (in het geval van een kristal) kenmerkt zich door deeltjes die dicht op elkaar zijn gepakt en vastzitten in een keurig rooster.
Roel van der Heijden voor NEMO KennislinkEfficiënte schikking
Als je maar ver genoeg inzoomt op een materiaal kom je uiteindelijk bij atomen terecht, de kleinste chemische bouwstoffen waarin veel eigenschappen van een stof besloten liggen. Niet alleen wélke van de pakweg honderd verschillende atomen er in een materiaal zitten bepalen zijn eigenschappen, maar ook de ordening.
In veel vaste stoffen nemen de atomen een nette ordening aan. Dit is wat betreft energie de meest efficiënte schikking, maar het lukt deeltjes niet altijd om zich zo te organiseren. Vervuiling in de vorm van andersoortige atomen voorkomt dat de deeltjes zich netjes schikken. Het glas in onze vensters en drinkglazen is een van de bekendste voorbeelden, dat voornamelijk bestaat uit ongeordende silicium- en zuurstofatomen.
Deze glasfase is in natuurkundig opzicht gewoon een vaste stof, maar lijkt onder krachtige microscopen sprekend op de vloeibare fase. “Dat is best vreemd”, zegt Liesbeth Janssen, die als universitair docent van de Technische Universiteit Eindhoven theoretisch onderzoek doet naar de glasfase. “Normaal gesproken kun je enkel op basis van de atomaire of moleculaire ordening al zeggen met wat voor fase je te maken hebt: een gas, een vloeistof of vaste stof.”

Glazen flessen. Strikt genomen vloeit glas, maar dat doet het zó traag dat het pas waarneembaar is op tijdschalen die in de buurt komen van de totale leeftijd van het heelal.
Viewminder via CC BY-NC-ND 2.0Onbekende effecten
Janssen en collega’s proberen in hun onderzoek zo dicht als mogelijk bij het punt te komen dat een vloeibare stof overgaat in een glasachtige vaste stof. Het moment waarop de stroperigheid (ook wel viscositeit) in het materiaal plots enorm toeneemt. “Dat gebeurt wanneer een vloeistof supergekoeld wordt”, zegt Janssen. “Het is dan ónder de kristallisatietemperatuur, maar het vloeit nog. Dit is een interessant temperatuurgebied, want we zien dat die deeltjes plots langzamer bewegen. Wat we niet goed begrijpen is hoe deze ogenschijnlijke ‘verstening’ van de vloeistofordening werkt en waarom de deeltjes zich niet herordenen in een nette kristalstructuur, zoals in andere materialen.”
Is het niet logisch dat atomen steeds langzamer bewegen als ze worden afgekoeld? Temperatuur is immers gedefinieerd als de mate van beweging van de deeltjes. Toch is het verstarren van atomen niet te verklaren met alleen het kouder worden. Er zijn andere effecten aan het werk die nog niet goed worden beschreven door bestaande theorieën, aldus Janssen. Er is geen universele theorie die het stollingsproces van alle materialen voorspelt.
Oplossingen
Onderzoekers hebben overigens best een aardig idee van wat er zich in een materiaal afspeelt, hoe individuele atomen bewegen en interacties aangaan in hun directe omgeving. Maar het is juist het collectieve gedrag waar geen goede beschrijving voor is. Een materiaal bestaat eigenlijk per definitie uit een enorm aantal atomen, die op allerlei verschillende manieren interactie hebben. Draait het stollingsproces om de locale krachten tussen buuratomen, of moet je de interacties met de buren van de buren ook meenemen? Welke rol speelt de hoek tussen verschillen deeltjes, de afstanden en temperatuur? Onderzoekers zoals Janssen zoeken vooral naar de juiste ‘filter’ die zegt welke effecten het belangrijkst zijn.
Eígenlijk is er geen oplossing voor dit probleem. “We weten dat dit niet exact op te lossen is met de wiskunde die we nu hebben, er spelen zoveel invloeden dat de berekening oneindig groot wordt”, zegt Janssen. “Ons werk heeft de afgelopen jaren gedraaid om het vinden van zogenoemde gekoppelde vergelijkingen die alle effecten beschrijven en waarbij de effecten zo gerangschikt zijn dat ze een steeds kleinere rol spelen. Als we vervolgens alleen de eerste paar niveau’s meenemen dan zijn we al een heel eind.”
Algoritmes kunnen helpen in het onderzoek. In toenemende mate gebruiken de onderzoekers rekenprogramma’s die door het aanbrengen van kleine variaties op zoek gaan naar de belangrijkste termen in de formules. Dat in tegenstelling tot de klassieke benadering waarin computers werd opgedragen om zoveel mogelijk niveau’s mee te nemen, totdat ze door geheugengebrek niet meer verder komen.

Een druppel. Bij andere aggregatietoestanden zoals een vloeistof is bekend wat de dominante krachten zijn. Wetenschappers hopen dat ook voor het ontstaan van glasachtige (ofwel amorfe) stoffen te vinden, waarbij de structuur hetzelfde is als een vloeistof maar het gedrag hetzelfde is als een vaste stof.
Mibby23 via CC BY-NC 2.0Maar hoe weet je of wat de computer voorspelt ook echt zo is? Dit kan bijvoorbeeld met een oplossing van deeltjes van tussen de tien en duizend nanometer groot. Veel groter dan atomen en daarom ook beter volgbaar met een microscoop. Een andere mogelijkheid is het volgen van daadwerkelijke atomen via een techniek die röntgendiffractie heet. “Een uitgebreid computermodel komt na een maand berekenen eigenlijk nog niet in de buurt van de glasovergang. We beginnen in de vloeibare fase en komen dan ergens uit in het supergekoelde regime, waar de atomen nog steeds bewegen. Een computer kan zo een week rekenen om het model slechts een nanoseconde verder te brengen”, zegt Janssen.
Van atomen naar tumorcellen
Het begrijpen van hoe een amorf materiaal zich precies gedraagt op atomaire schaal levert naast fundamentele kennis ook toepassingen in andere vakgebieden op. Zo probeert Janssen samen met andere wetenschappers om de theorie toe te passen op de vraag of cellen in een lichaam ‘vast’ zitten in een weefsel of beweeglijk zijn en zich dus verspreiden. In het geval van kanker kan dat het verschil betekenen tussen een tumor die zich uitzaait of stabiel is.

Het werkgeheugen van een computer. Een materiaal dat verschillende vaste fases heeft kan dienen als computergeheugen. Het principe wordt mondjesmaat toegepast als het zogeheten phase-change random-access memory.
Dennis Sylvester Hurd via publiek domein“Natuurlijk lijken cellen in een lichaam helemaal niet op atomen in een materiaal. Er zijn andere interacties aan het werk, de schaal is veel groter en cellen kunnen van vorm veranderen. Toch blijken onze theorieën iets zinnigs te zeggen over de kans dat cellen bewegen of niet”, zegt Janssen. “Hopelijk kunnen we straks op basis van een foto van een weefsel zeggen of de cellen zullen bewegen of niet.”

