Er is flink wat innovatie gaande op het gebied van proefdieralternatieven. Hebben proefdieren hun langste tijd gehad? We praten met universitair hoofddocent Bart Spee over een van de meest kansrijke alternatieven: organoïden.
De afbouw van het aantal proefdieren is ingezet. De Europese Unie heeft regels die daarin voorzien: zo gauw er alternatieven zijn die dat wetenschappelijk en technologisch mogelijk maken, mogen geen proefdieren meer worden gebruikt. Hoewel dat in de nabije toekomst nog niet het geval is, zijn er intussen wel alternatieven die een grote kans maken.
Mini-orgaantjes
Organoïden, die kleine klompjes doorgekweekte stamcellen, staan al jaren te boek als alternatief nummer een. Wetenschappers in labs en klinieken over de hele wereld gebruiken deze mini-orgaantjes al bij onderzoek op maat. Door ze bloot te stellen aan een mogelijk geneesmiddel kunnen onderzoekers te weten komen of en hoe het werkt bij een patiënt. Die aanpak kan er op termijn voor zorgen dat er minder proefdieren nodig zijn.
Bart Spee, universitair hoofddocent bij de Universiteit Utrecht, gaat nog een stapje verder. In zijn lab ontwikkelen hij en zijn collega’s celmodellen gebaseerd op organoïden, die specifiek bedoeld zijn om diermodellen te vervangen. “De lever-organoïden die wij gebruiken zijn afkomstig van materiaal dat overblijft nadat wordt gecontroleerd of een donorlever geschikt is voor transplantatie”, zegt Spee. “Daarvoor wordt een biopt uit het orgaan genomen om te bepalen of het gezond genoeg is. Uit het restmateriaal kweken we organoïden op met een succeskans van bijna 100 procent.”
Dankzij die aanpak heeft Spee intussen de beschikking over een biobank vol verschillende mini-levertjes afkomstig van mannen, vrouwen, maar ook van allerlei etniciteiten. Deze organoïden kunnen worden gebruikt om de toxiciteit of ‘giftigheid’ van nieuwe geneesmiddelen te testen, met name om te bepalen welke medicatie het best past bij welke patiënt.
“Als je test op allerlei verschillende cellen maakt dat je onderzoek representatiever”, zegt Spee. “Iedere persoon is anders, terwijl de dieren in een dierproef dat bij uitstek niet zijn. Die worden gefokt met als doel om de populatie zo homogeen mogelijk te houden.” Dat verklaart meteen waarom zo’n diermodel niet erg waardevol is bij het testen van mogelijke geneesmiddelen. “Wij mensen verschillen ook heel erg van elkaar”, zegt Spee. “Dat verschil kun je nabootsen met organoïden van meerdere weefseldonoren. Homogeniteit wil je hierbij juist vermijden.”
Het screenen van organoïden met de microscoop.
Bas NiemansDoor die homogeniteit van proefdieren worden giftige stoffen vaak over het hoofd gezien. Niet iedereen reageert namelijk hetzelfde op een stof die in het lichaam komt. “Alles wat je inneemt gaat via je darm als eerste naar de lever, zodat die giftige stoffen uit het bloed kan filteren”, zegt Spee. “Als er ergens schade optreedt, is het daar.” In het verleden kwamen veel medicijnen op de markt die in grotere groepen mensen toch giftig voor de lever bleken te zijn.
“Met een dierproef kun je slechts 50 tot 60 procent van de giftige medicijnen ondervangen”, zegt Spee. “Vaak wordt dat pas duidelijk in de laatste fase van geneesmiddelenonderzoek, al nadat een geneesmiddel beschikbaar is.” En zo kan het gebeuren dat een medicijn alsnog van de markt moet worden gehaald.
Voorspelbaarheid
In Europese regelgeving staat dat een geneesmiddelfabrikant een nieuw stofje moet testen in proefdieren voordat het op mensen mag worden getest. “De richtlijnen weerspiegelen de uitdaging waar ons onderzoeksveld mee zit”, zegt Spee. “Er is behoefte aan een zekere mate van standaardisatie. Er zijn zoveel variabelen: hoe meet je het resultaat, welke cellen gebruik je, hoe spuit je ze in kweekplaatjes, hoe kweek je ze op?” Spee en zijn collega’s maken daarom voor het laboratoriumwerk gebruik van robots. “Zo maken we het uitplaten zo gestandaardiseerd mogelijk.”
Toch is ook een celmodel op basis van organoïden niet de heilige graal. “Een enkel celtype, zoals een levercel, is niet volledig representatief voor een volledig orgaan”, zegt Spee. “Dat bevat ook allerlei soorten ondersteunende cellen en structuren zoals bloedvaten.” Een volledig orgaan is op zijn beurt weer niet representatief voor het hele lichaam. Ook de nieren en het immuunsysteem spelen een rol bij het opruimen en uitscheiden van een giftige stof. “Daarom werken we aan het opbouwen van complexiteit. Als we een weefsel beter kunnen nabootsen wordt een organoïde nog voorspelbaarder.”
Om die voorspelbaarheid nog verder te verbeteren, zijn er intussen al mogelijkheden om organoïden van bijvoorbeeld de lever en de nieren aan elkaar te koppelen op een chip. Die technieken staan nog in de kinderschoenen en blijven daar waarschijnlijk hangen, denkt Spee. “Ik voorzie niet dat we een volledig systeem zoals het lichaam kunnen nabootsen met alle relevante aspecten. Dat wordt zó complex dat de reproduceerbaarheid daaronder lijdt. Maar dat neemt niet weg dat we daarmee wel onze vragen over toxiciteit in stukjes kunnen breken – de lever, de nier, het hart – en dat individueel aanvliegen. Dat kan zeker zorgen voor een grotere mate van voorspelbaarheid.”
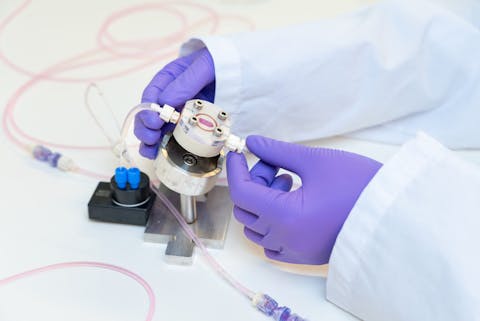
Een organ-on-a-chip met een leverorganoïde.
Bas NiemansDie complexiteit zorgt ervoor dat de farmaceutische industrie moeite heeft om methoden uit het onderzoeksveld over te nemen. “Het bedrijfsleven heeft vaak minder kennis en materialen beschikbaar dan de onderzoekswereld”, zegt Spee. “Ik denk dat veel bedrijven voorlopig hun vingers niet willen branden aan zo’n complex systeem als gekoppelde organoïden. Toch zijn er al best wat farmaceuten die tests doen op menselijke cellen en afzonderlijke organoïden.”
Schijnveiligheid
In de tijd tussen nu en proefdiervrij zitten we met een matige gouden standaard, vindt Spee. “Die redenering gaat twee kanten op: enerzijds gaan mogelijke geneesmiddelen met vlag en wimpel door proefdiermodellen heen, maar blijken ze bij de mens toch problemen te geven. Anderzijds houden die proefdiermodellen stofjes tegen die giftig zijn voor dieren, maar die voor mensen prima geschikt zouden zijn geweest. Proefdiermodellen bieden schijnveiligheid. Dat is onwenselijk.”
Spee hoopt dat de bestaande, gebrekkige Europese regelgeving een vervolg krijgt en de eis voor dierproeven bij geneesmiddelenonderzoek op termijn verdwijnt, maar dat dat besluit wel gepaard gaat met keuzes. “Ik zie veel interesse om in alternatieve modellen te investeren, maar er zijn er ook erg veel in ontwikkeling. Als de Europese geneesmiddelenautoriteit EMA besluit dat proefdiervrije alternatieven mogen, dan is de vraag of bedrijven dat ook echt gaan doen. Ik denk dat er een push moet komen voor de beste modellen, waardoor deze duidelijk toepasbaar zijn.” Als de regelgeving meegroeit, denkt hij dat proefdiervrije alternatieven over tien jaar gemeengoed zullen zijn in de farmaceutische industrie. “Het zullen nog geen erg complexe modellen zijn, maar waarschijnlijk beperkt tot één modelsysteem dat voorspelbaar genoeg is. Maar we moeten ergens beginnen.”
Nabij proefdiervrij
In 2016 sprak kabinet Rutte II de ambitie uit om Nederland in 2025 'grotendeels proefdiervrij' te maken. Dat is een stevige ambitie, aangezien er nu jaarlijks nog zo'n 400 duizend dierproeven plaatsvinden in ons land. Kan dat niet minder? En kan biotechnologie daar een rol in spelen?