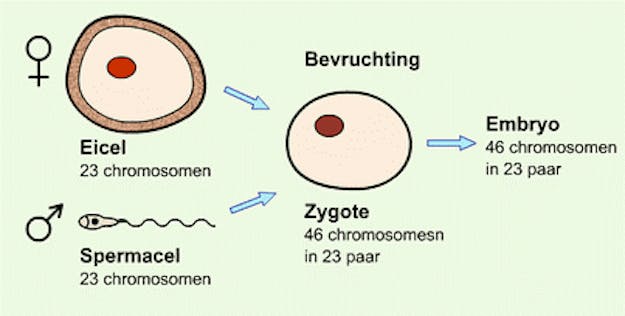
Als de ontwikkelingen in dit tempo doorgaan, is het straks mogelijk dat twee mannen een biologisch eigen kind krijgen. Met eicellen gemaakt uit nier- of huidcellen.
Met een flacon voorzien van maatstreepjes sta je op de wc. Je probeert er zo goed mogelijk in te richten en de boel niet vies te maken. Beschaamd lever je de nog warme flacon in. De laborant plakt er een sticker met je gegevens op en dan kan het naar het lab waar het gele goedje gefilterd wordt. Wat overblijft zijn onder andere niercellen, die altijd in urine zitten.
Laboranten zorgen er vervolgens voor dat deze niercellen vergeten dat ze niercel zijn. Met een cocktail aan verschillende chemische stoffen worden genetische codes die in de cellen aanstaan, uitgezet. Ze worden weer stamcellen: cellen die nog tot alle celtypes uit kunnen groeien.
Met een andere stoffencocktail krijgen de cellen vervolgens te horen wat ze zullen worden: zaadcellen. Of eicellen. Net afhankelijk van wat nodig is. De cellen worden bevrucht en een nieuw embryo ontstaat.
Meer scenario's
Zo zouden homostellen in de toekomst een biologisch eigen kind kunnen krijgen. Een van de vaders levert wat urine of huidcellen in. Van die cellen worden eicellen gemaakt en die worden bevrucht met zaadcellen van de andere vader. De beste embryo’s worden in de baarmoeder van een draagmoeder geplaatst, in een kunstbaarmoeder of zelfs in een baarmoeder die naar een van de mannen wordt getransplanteerd.
Wat ook kan: stellen waarbij een van de twee wensouders onvruchtbaar is werkende geslachtscellen geven die uit de eigen urine of huid gemaakt zijn. En ook voor een ‘gewone’ IVF-procedure kan het heel handig zijn als artsen de gewenste eicellen uit urine of huidcellen kunnen opkweken. Dan hoeft een vrouw geen belastende hormoontherapie en eicelpunctie te ondergaan waarbij de eicellen met een naald uit de eierstokken worden gezogen.
Zover als deze scenario’s reiken, zijn we nog niet, maar de wetenschap komt al aardig in de buurt.
Muizenbaby’s uit huidcellen
Want de ontwikkelingen gaan razendsnel. De eerste grote stap werd in 2012 in Japan gezet toen het Katsuhiko Hayashi van de Kyushu Universiteit lukte om huidcellen van een vrouwtjesmuis om te zetten in stamcellen. Die stamcellen zette hij om in zogeheten primordiale kiemcellen; zeg maar primitieve ei- en zaadcellen. Door deze voorlopercellen in de eierstokken van levende muizen te stoppen, ontstonden eicellen.
Vier jaar later ging de Japanner nog een stukje verder met zijn team. Dit keer lukte het hen om de hele celontwikkeling buiten de muis, in een lab, te laten plaatsvinden. Het was voor het eerst dat iemand erin slaagde huidcellen van een vrouwtjesmuis om te programmeren naar eicellen buíten het lichaam van het dier.
Geslachtscellen maken is moeilijk omdat ze maar de helft van het DNA bevatten. Ergens moet de cel dus delen zodat uiteindelijk een versmolten ei- en zaadcel samen weer de juiste hoeveelheid DNA hebben. De meiose heet die deling. In eierstokken krijgen voorlopercellen continu de juiste signalen om te veranderen in geslachtscellen. In het lab is daar meer voor nodig.
Het lukte Hayashi en met behulp van IVF werden 26 gezonde muizen geboren uit de gemaakte ei- en zaadcellen van een donormuis. En ook die muizen kregen weer baby’s.
Vorig jaar liet hij in tijdschrift Nature zien dat het hem gelukt was om muizen met twee biologische vaders te maken door eicellen van mannelijke huidcellen te gebruiken. De wetenschappers maakten daarbij gebruik van het feit dat stamcellen tijdens de gewone celdeling weleens een chromosoom verliezen, legt Susana Chuva de Sousa Lopes uit. Zij is hoogleraar ontwikkelingsbiologie aan het Leids Universitair Medisch Centrum. Bijna in alle gevallen leidt dat proces tot celdood. Maar bij sommige chromosomen, zoals de geslachtschromosomen, niet. Iemand met het syndroom van Turner heeft bijvoorbeeld slechts één X-chromosoom in een deel van de cellen of in alle cellen.
Een kind met jezelf
“Het is zo simpel dat het geniaal is”, zegt Chuva de Sousa Lopes. “De truc is geduld. De onderzoekers stopten één cel in ieder welletje (putje in een soort plastic plaat, red.) en wachtten dan een paar weken. Dat was het. Briljant toch?” Tijdens die weken ondergaan de cellen gewone celdelingen, ook wel mitotische celdeling genoemd. Bij die delingen verdubbelt eerst de hoeveelheid DNA, en daarna gaan de cellen uit elkaar. Zo heeft iedere dochtercel evenveel DNA als de moedercel.
Maar. Na twee weken waren enkele cellen het Y-chromosoom verloren terwijl ze van alle andere chromosomen er keurig twee hadden. En daar maakten de onderzoekers handig gebruik van. Ze gaven die Turner-cellen de stof reversine.
“Dat is een goedje dat ervoor zorgt dat chromosomen bij elkaar blijven tijdens celdelingen”, legt de Leidse bioloog uit. Dus de moedercel verdubbelt tijdens een mitotische deling haar DNA en er ontstaan twee X’en. Door reversine gaat er nu niet één X-chromosoom naar beide dochtercellen, maar krijgt één dochtercel er twee. De dochtercel die geen geslachtschromosomen krijgt, sterft af. “En zo kwamen de onderzoekers in een paar weken van XY-cellen naar XX-cellen.”
Die cellen ondergaan vervolgens de meiose waardoor er eicellen ontstaan die de helft van het DNA hebben. De ontstane eicellen bevruchtten de onderzoekers met normale zaadcellen van een andere muis en zo kreeg het team ongeveer 600 muizenembryo’s. Die plaatsten ze vervolgens in draagmoedermuizen, waardoor er uiteindelijk zeven babymuizen werden geboren. De hele procedure is dus nog niet bepaald efficiënt te noemen. “Ter vergelijking: als de onderzoekers eicellen van een vrouwtjesmuis via een punctie hadden gehaald, die hadden bevrucht en hadden teruggeplaatst, dan was het in honderd procent van de gevallen gelukt om muizenpups te krijgen.”
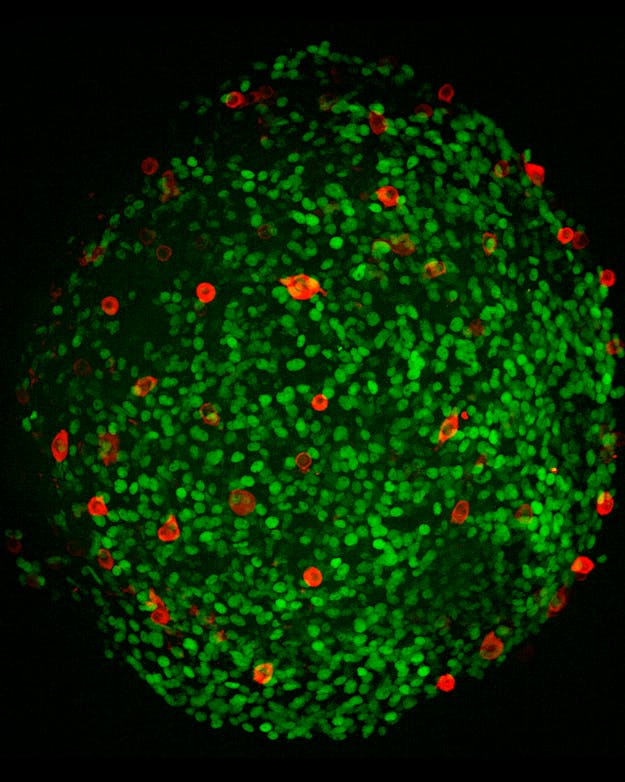
Mini-testis organoid met voorlopers van voorplantingscellen
Celine Roelse“In theorie hadden de onderzoekers ook zaadcellen van dezelfde muis kunnen gebruiken om de gemaakte eicellen te bevruchten”, zegt Chuva de Sousa Lopes. “Dan krijgt het dier een kind met zichzelf. Je kunt het zo gek niet bedenken, of het is in theorie mogelijk.” Of het in de praktijk kan, heeft nog geen onderzoeker laten zien.
Wat nog moeilijk blijkt, is om een zwemmende spermacel te maken. Chinese wetenschappers slaagden er in 2016 in om muizenhuidcellen om te programmeren naar primitieve zaadcellen zonder staart, maar al wel met de helft van het DNA; de zogeheten spermatiden. Die spermatiden bleken in staat eicellen te bevruchten en ook uit die embryo’s werden levende muizen geboren.
Maar al zou het lukken om zaadcellen uit vrouwelijke huidcellen te maken, dan zouden twee vrouwtjesmuizen alsnog alleen dochters kunnen krijgen. Dat Y-chromosoom kunnen wetenschappers niet zomaar ergens vandaan toveren namelijk.
En de mens dan?
En dan hebben we het nog over muizen. De vraag is hoe snel dit soort technieken voor de mens toepasbaar zijn én of we daarop zitten te wachten. Hayashi voorspelde vorig jaar tijdens de presentatie van zijn resultaten dat het voor 2033 mogelijk zal zijn een levensvatbare menselijke eicel te creëren uit een mannelijke huidcel.
Daar werken Chuva de Sousa Lopes en collega’s in Nederland hard aan. Om van stamcellen naar ei- of zaadcellen te komen, zijn tien stappen nodig, legt ze uit. “Iedere stap gaat de cel steeds een beetje meer op een voortplantingscel lijken.”
De onderzoekers zijn nu zo ver dat ze de eerste stap met zeventig procent efficiëntie kunnen maken. Dat wil zeggen dat het bij zeventig procent van de cellen lukt om van stamcel naar de volgende stap te gaan. “In die stap hebben de cellen nog best veel eigenschappen van de oorspronkelijke stamcellen. In de volgende stap moeten die allemaal weg.” Na stap twee wordt het ook duidelijk of een cel zaad- of eicel wordt. In Japan is die tweede stap eind mei gelukt. De derde stap is de moeilijkste. Het is de eerste fase van de meiose: het proces waarin het DNA zich verdeelt over twee dochtercellen.
Het proces bij mensencellen is vanwege allerlei veiligheidsmaatregelen ingewikkelder. Zo moeten de kweekcondities zo zijn dat de geslachtscellen uiteindelijk in de kliniek gebruikt kunnen worden. Toch werkt de ontwikkelingsbioloog bewust niet meer met muizen. “Wij kunnen niet tegen Japan op. Ze hebben andere ethische regels voor hun onderzoek en kunnen bijvoorbeeld duizenden muizen gebruiken. Als ik dat in Nederland zou voorstellen, zouden de ethische commissies me hard uitlachen.”
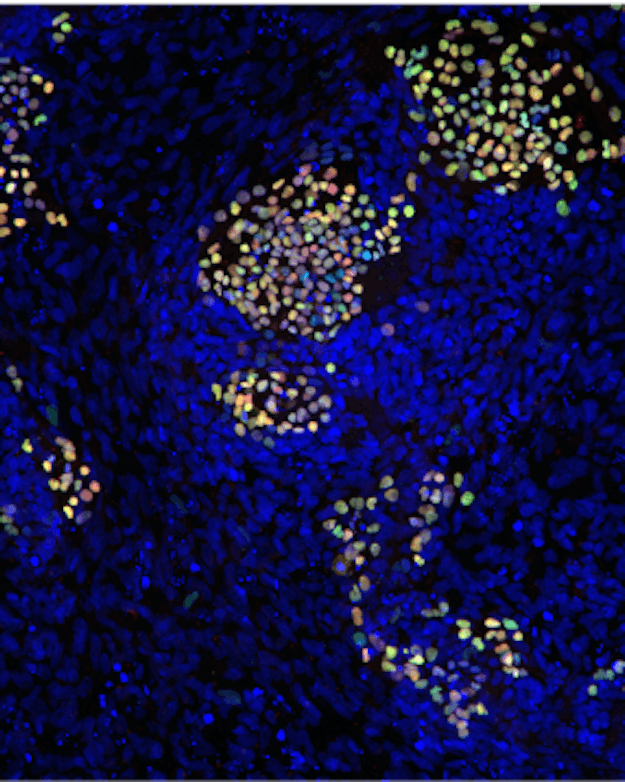
Eerste stap op weg van stamcel naar een voortplantingscel (rode en groene cellen) in het onderzoek van Susana Chuva de Sousa Lopes.
Marjolein TrimpHoelang het nog duurt voordat we bij stap tien zijn durft Chuva de Sousa Lopes niet te zeggen. “Wetenschappelijke doorbraken kunnen in schokken gaan. Wij hebben nu een protocol gemaakt voor stap 1 en stap 2 lijkt dus ook mogelijk, laten ze in Japan zien. Dat maakt het voor andere onderzoeksgroepen makkelijker om verder te gaan. Misschien zorgt dat voor een versnelling. Let’s go!”