Willen we onze aarde leefbaar houden voor onze nakomelingen, dan moeten we al onze materialen en chemicaliën op een efficiëntere manier produceren. Dat kan alleen met nieuwe katalysatoren. Chemicus Bas de Bruin van de Universiteit van Amsterdam vertelt hoe hij gereedschappen uit de natuur gebruikt om duurzame, synthetische katalysatoren te ontwikkelen.
We weten allemaal dat de uitlaat van onze auto is uitgerust met een katalysator. Een katalysator in de uitlaat van een auto versnelt de ontleding van schadelijke stikstofoxides in de uitlaatgassen. Het is een nuttig onderdeel, want het vermindert de uitstoot van schadelijke stoffen in de lucht die we inademen.
Ook in de biologie wordt veelvuldig gebruikt gemaakt van katalyse. Enzymen zorgen er bijvoorbeeld voor dat stofwisselingsprocessen in levende cellen snel, schoon en dus efficiënt verlopen. Vaak verloopt een chemische reactie, of een biochemisch proces, zelfs helemaal niet zonder de hulp van een katalysator.
Toepassing van katalyse
De chemische industrie maakt veelvuldig gebruik van katalyse om reacties sneller, schoner en goedkoper te laten verlopen. Een goed voorbeeld van een industriële katalysator is een polymerisatiekatalysator. Zo’n katalysator maakt het mogelijk om plastics te maken zoals polyetheen en polypropeen, die we allemaal dagelijks gebruiken. Om polyetheen te maken heb je etheengas nodig, dat gewonnen wordt uit aardolie. Dat gas reageert niet spontaan met zichzelf. Alleen met behulp van een katalysator wordt etheengas onder hoge druk gepolymeriseerd tot het plastic polyetheen.
Ook in de industriële synthese van medicijnen, landbouwproducten, insecticiden, herbiciden, fungiciden, antibiotica en vele andere biologisch actieve verbindingen is het gebruik van een katalysator cruciaal. Er wordt wereldwijd erg veel gebruik gemaakt van katalyse. Er wordt dan ook veel moeite in gestoken, veel geld in geïnvesteerd en veel geld mee verdiend.
Duurzaamheid
Toch, als we onze aarde leefbaar willen houden voor onze kinderen en kleinkinderen dan moeten we nieuwe katalysatoren ontwikkelen. De wereldbevolking groeit in een schrikwekkend tempo. Al die mensen willen een koelkast, een auto, voldoende voedsel, een nieuwe telefoon, ze verbruiken energie en consumeren goederen. Dit creëert allerlei ecologische problemen en veroorzaakt milieuverontreiniging. Daar kunnen we alleen iets aan doen door al onze materialen en chemicaliën op een nog efficiëntere en duurzamere manier te produceren. Dat kan alleen met nieuwe, betere en goedkopere katalysatoren, die ervoor zorgen dat de reacties schoner verlopen en minder energie verbruiken.
Katalysatoren gebaseerd op de edelmetalen, zoals rhodium, iridium, goud, platina en in mindere mate ook ruthenium, osmium en wolfraam, worden steeds duurder omdat die elementen simpelweg op dreigen te raken. Omdat er zoveel edelmetaal gebruikt wordt in de katalysatoren van auto’s is de prijs van die metalen de laatste jaren enorm omhoog geschoten.
Om daar een oplossing voor te vinden moeten we werken aan de ontwikkeling van nieuwe katalysatoren die gebaseerd zijn op veel goedkopere grondstoffen. Echter, het vervangen van edelmetalen in de bestaande katalysatoren door goedkopere metalen is nog niet zo gemakkelijk. Goedkopere metalen reageren namelijk vaak via radicaalreacties, en die begrijpen we nog niet zo goed. Van radicalen wordt over het algemeen aangenomen dat ze niet of heel moeilijk te controleren zijn. In veel gevallen klopt dat ook. Als we bijvoorbeeld aardgas willen omzetten in methanol met behulp van radicalen, dan mondt de reactie vrijwel onvermijdelijk uit in de volledige verbranding tot CO2 en water.
Dat maakt het lastig om selectieve reacties uit te voeren. Er wordt daarom vaak aangenomen dat radicalen te reactief zijn om selectief te kunnen reageren. Dit is echter een dogma. Lang niet alle radicalen zijn even reactief. Uit onderzoek van de laatste jaren is gebleken dat er veel reacties mogelijk zijn waarbij koolstofradicalen juist héél selectief reageren.
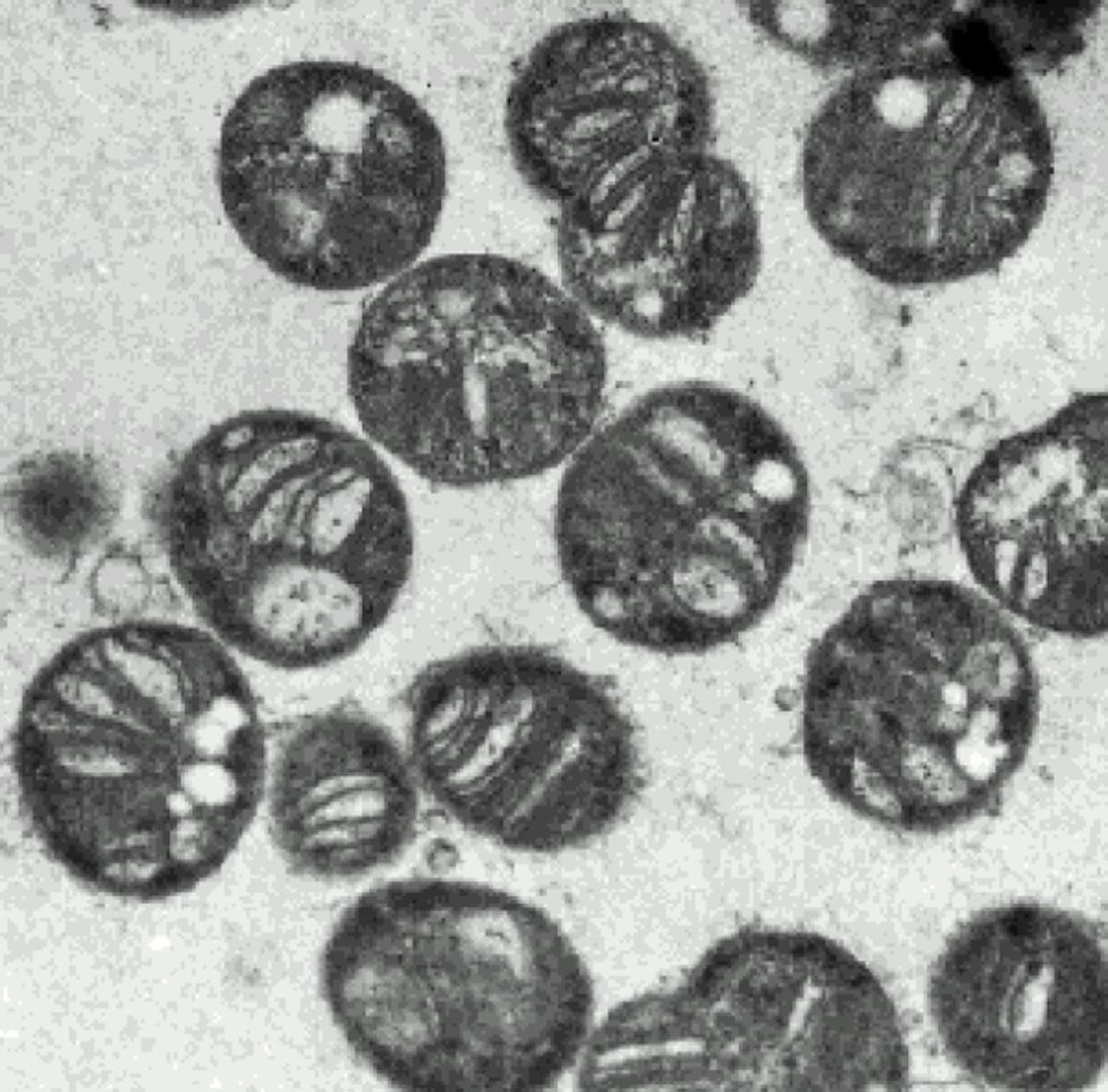
Deze van methaan houdende bacteriën bevatten een enzym dat methaan omzet in methanol.
Wikimedia Commons/Anne FjellbirkelandInspiratie uit de biologie
We kunnen dus niet zeggen dat radicalen altijd te reactief zijn. Bovendien, als de gewenste reactie veel sneller is dan een ongewenste reactie, dan maken we selectief het gewenste product, ongeacht de absolute reactiesnelheid. Met een katalysator kunnen we snelle radicaalreacties wel degelijk gebruiken om nuttige reacties uit te voeren.
Sterker nog, als je goed kijkt naar de biochemische processen in ons eigen lichaam, dan kom je erachter dat de meest interessante reacties die gekatalyseerd worden door metaalhoudende enzymen bijna allemaal radicaalreacties zijn!
Een voorbeeld is methaan-monooxygenase. Dit enzym komt voor in bepaalde bacteriën en is in staat om methaan selectief om te zetten in methanol. Het enzym katalyseert dus precies die reactie waarvan het proces erg gemakkelijk uit de hand loopt. In aanwezigheid van het enzym wordt methaan echter niet volledig verbrand tot CO2 en water, maar de reactie stopt netjes bij methanol. Opmerkelijk genoeg gebruikt ook dit enzym daar echter wel radicaalreacties voor!
Dit is slechts een voorbeeld waarbij de natuur ons laat zien dat we helemaal niet bang moeten zijn voor radicaalreacties. Selectieve katalytische radicaalreacties zijn wel degelijk mogelijk en mooier nog, enzymen doen dat niet met edelmetalen, maar met royaal beschikbare metalen zoals ijzer en kobalt. Waarom gebruiken we dan niet gewoon enzymen?
Helaas werkt dat niet altijd. Enzymen zijn lang niet altijd geschikt voor de reacties die we willen uitvoeren. Voor veel reacties is er simpelweg geen enzym beschikbaar en veel enzymen zijn moeilijk te isoleren of zijn niet stabiel genoeg buiten hun natuurlijke membraan. Vaak zijn enzymen ook te specifiek om industrieel interessant te zijn. Tenslotte kan het gebruik van enzymen ook erg duur zijn.
We kunnen echter wel veel leren over het gecontroleerd laten verlopen van radicaalreacties door goed te kijken naar enzymen en hoe ze hun werk doen. Mijn onderzoeksgroep aan de Universiteit van Amsterdam (UvA) wil de gereedschappen die de natuur gebruikt om radicaalreacties te laten verlopen toepassen in de synthetische katalyse. Dit zijn dus gereedschappen geïnspireerd op de biologie, maar die gebruikt worden om nieuwe synthetische katalysatoren te maken. Dit noemen we bio-geïnspireerde katalyse.
Geen ijzer maar kobalt
Mijn onderzoeksgroep heeft al een paar keer aangetoond dat bio-geïnspireerde katalytische radicaalreacties mogelijk zijn. We hebben daar kobalt-verbindingen voor gebruikt die een beetje lijken op het reactieve onderdeel van een aantal belangrijke enzymen. Een voorbeeld is heem. Heem is de rode kleurstof in ons bloed, maar het is ook het reactieve onderdeel van heel veel metaalhoudende enzymen – meestal ijzer – in ons lichaam. De katalysatoren die onze groep in Amsterdam gebruiken lijken een beetje op heem, maar dan gebaseerd op kobalt in plaats van ijzer.
Deze kobalt-verbindingen reageren snel met moleculen die gemakkelijk stikstof verliezen. Het meest interessant aan deze reacties is het feit dat we op deze manier, net als bij enzymen in de natuur, reactieve radicalen kunnen vormen die aan kobalt gebonden blijven zitten.
Eén kobalt-katalysator is in staat om veel moleculen van de uitgangsstoffen om te zetten in productmoleculen. De kobalt-katalysator wordt daarbij dus zelf niet verbruikt, net zoals dat gaat in de biologie.
Het meest interessant aan deze reacties is dat op deze manier allerlei belangrijke bouwstenen gemaakt kunnen worden die nuttig zijn voor de synthese van bioactieve moleculen, zoals medicijnen, voedingssupplementen, antibiotica, insecticiden en nog veel meer interessante stoffen.
Gezonde voeding
Een voorbeeld waarbij katalytische radicaalreacties een bijdrage kan leveren aan het efficiënter maken van de synthese van bioactieve stoffen, is de synthese van chromenen. Dranken en voedingsmiddelen waarvan voedingsdeskundigen menen dat ze erg gezond voor ons zijn, zoals tannine in thee en de sappen van allerlei groenten en vruchten, bevatten allemaal chromenen. Een aantal belangrijke medicijnen tegen kanker zijn ook gebaseerd op chromenen.
Die chromenen zijn echter niet zo gemakkelijk te maken; de syntheseroute bestaat meestal uit meerdere reactiestappen. Iedere stap produceert wat afval, en na iedere reactiestap moet het tussenproduct worden opgewerkt. Dat zijn nadelen die ten koste gaan van de efficiëntie en die het proces arbeidsintensief maken. Door gebruik te maken van kobalt en radicaalreacties zijn we er onlangs in geslaagd om diezelfde chromenen in één stap te maken uit redelijk goedkope uitgangsstoffen.
We denken dat dit een stap vooruit is in de synthese van chromenen. Maar het werk is nog lang niet klaar. Met de huidige methode is het bijvoorbeeld nog niet mogelijk om selectief slechts één van de twee spiegelbeeldvormen van deze moleculen te maken. Wat dat betreft is er dus nog veel werk te doen.

De synthetische katalysatoren die Bas de Bruin ontwikkelt zijn veelal gebaseerd op het metaal kobalt.
Wikimedia Commons/Alchemist-hpGebruik van nieuw gereedschap
Een van de problemen waarmee je te maken krijgt als je met radicalen werkt, is het feit dat die deeltjes een sterke neiging hebben om met zichzelf te reageren.
De natuur heeft daar een mooie oplossing voor gevonden. De radicaalreacties gekatalyseerd door enzymen vinden namelijk plaats in een enzymholte, een soort ‘doosje’ waarin zich het reactieve deel van de katalysator bevindt. Het doosje beschermt de katalysator tegen zichzelf en ingepakt gaat de katalysator veel minder snel kapot. Mijn collega’s en ik proberen dit aspect na te bootsen. We maken onze doosjes minder ingewikkeld dan die van enzymen, maar we bouwen wel degelijk beschermende doosjes om onze katalysatoren heen.
Een radicaal in een doosje kan niet reageren met een ander radicaal in een ander doosje, en zo voorkom je dat de katalysator zichzelf uitschakelt. Dit concept werkt goed, en in de nabije toekomst willen we nog veel meer van dit soort ‘duiveltjes in een doosje’ maken. Geïnspireerd door de natuur, net als natuurlijke enzymen, maar dan wel toegepast op heel andere reacties en met minder ingewikkelde katalysatoren.
We moeten zuinig omspringen met de energie en de atomen die ons door de natuur gegeven zijn. Daarom moeten we het met z’n allen radicaal anders aanpakken! En dat kan niet zonder (radicale) katalyse.