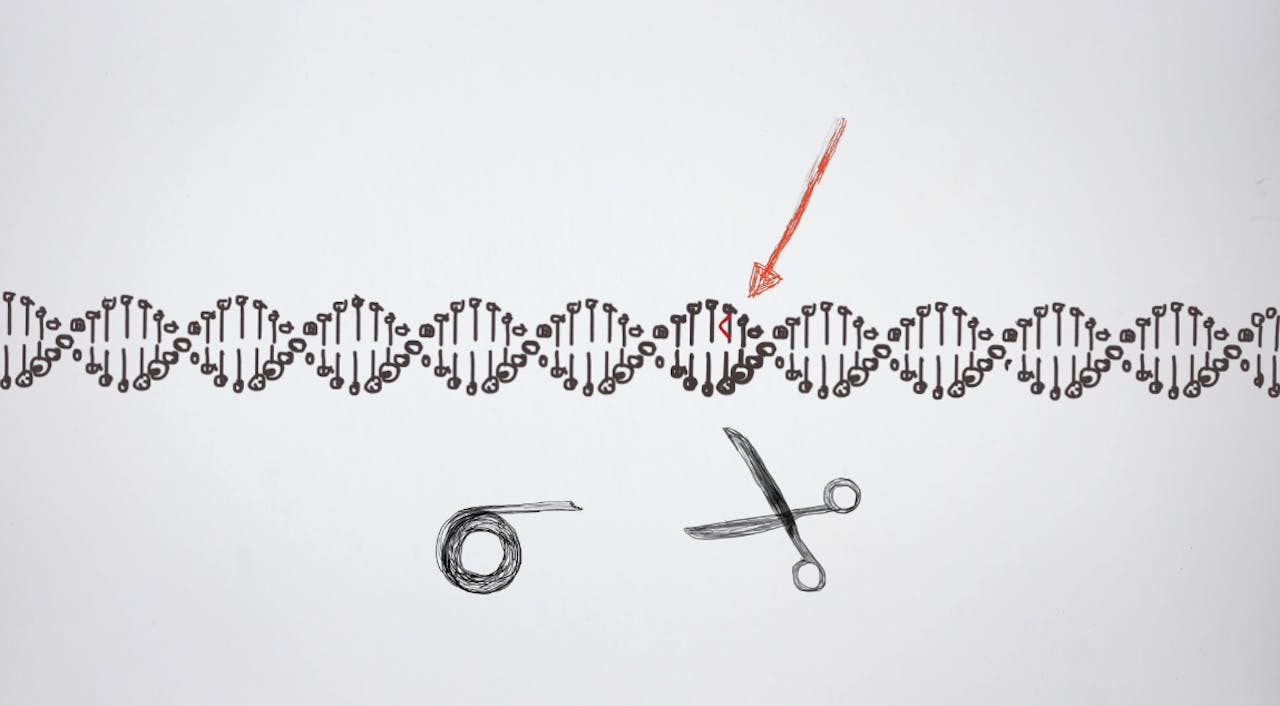
Met CRISPR-Cas is het in theorie mogelijk ziekteverwekkende mutaties in de genen van embryo’s te verwijderen. Maar voorkomen dat een kind ziek ter wereld komt, kan tegenwoordig ook met embryoselectie en dat lijkt vooralsnog veel veiliger. Dus wat voegt een CRISPR-Casbehandeling toe aan de mogelijkheden die er nu al zijn?
NEMO Kennislink schreef al veel over de nieuwe technologie CRISPR-Cas: een technologie waarmee het in de toekomst misschien mogelijk is het DNA van embryo’s aan te passen, zodat je genen die erfelijke ziektes veroorzaken, kunt repareren. Maar vooralsnog kleven er te veel risico’s aan deze techniek en is er nog weinig kennis over de efficiëntie en veiligheid. Daarom is het verboden CRISPR-Cas in te zetten bij de menselijke voortplanting.
Maar stel dat CRISPR-Cas in de toekomst wel gebruikt mag worden om het DNA van embryo’s aan te passen; wanneer in het hele voortplantingstraject zou dit dan moeten gebeuren? Op dit moment zijn er namelijk al veel prenatale screeningstechnieken beschikbaar voor toekomstige ouders die willen weten of hun ongeboren kind een erfelijke ziekte gaat krijgen. Ook is het al mogelijk om embryo’s zonder ziekte te selecteren tijdens een speciale IVF-behandeling.
Welke technieken worden nu toegepast?
Er zijn in Nederland verschillende prenatale screeningstechnieken beschikbaar voor toekomstige ouders die willen weten of hun ongeboren kind een erfelijke ziekte gaat krijgen. We zetten de meest toegepaste op een rij: je hebt de NIP-test, vlokkentest, vruchtwaterpunctie en een uitgebreide echo bij twintig weken zwangerschap. Daarnaast is er voor toekomstige ouders, die al vóór hun zwangerschap weten dat ze een erfelijke aandoening aan hun kind kunnen doorgeven, de mogelijkheid van embryoselectie. Na het maken van meerdere embryo’s via IVF, wordt alleen een embryo zonder de aandoening in de baarmoeder geplaatst.
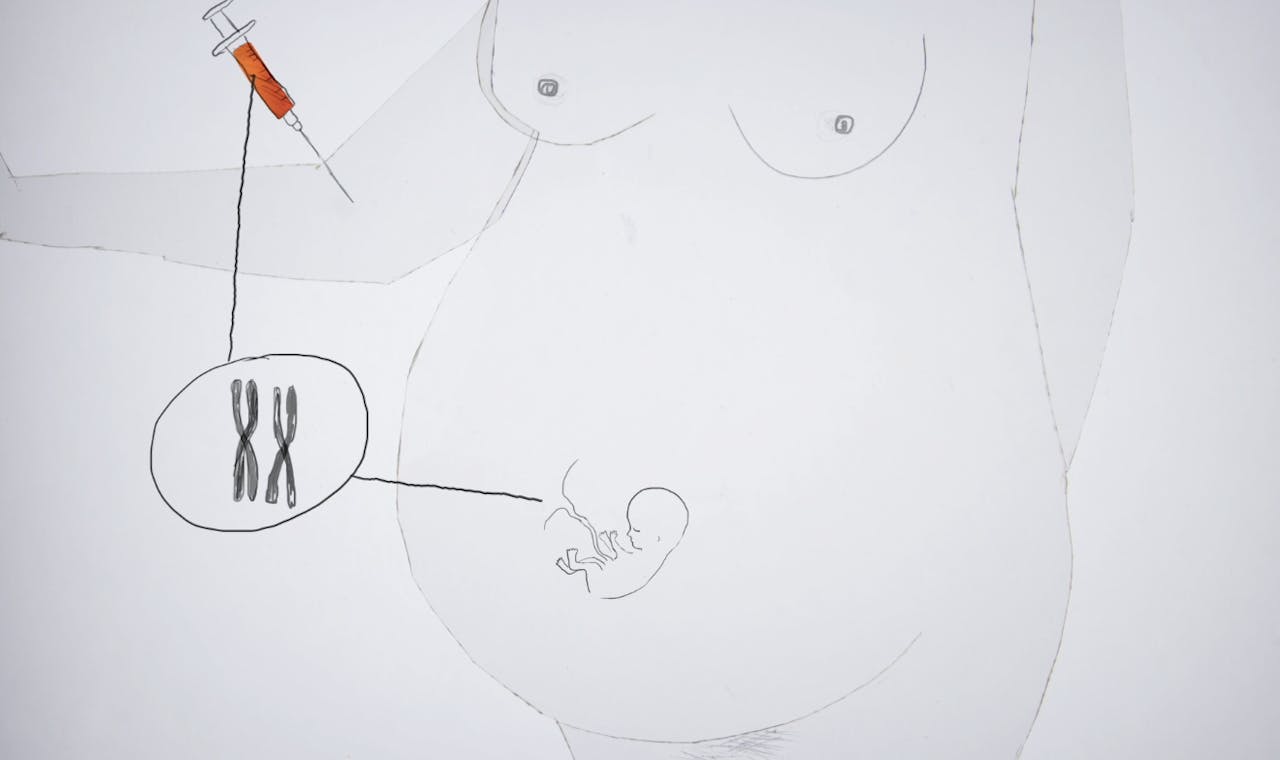
Bij een NIP-test wordt bloed afgenomen bij de moeder. Daarin zit wat DNA van de placenta, en dat lijkt op het DNA van het kind. De NIP-test wijst uit of het kind een chromosoomafwijking heeft.
Zaou Vaughan / Fast FactsAfwijkingen in chromosomen
De NIP-test is pas sinds 2017 beschikbaar in Nederland. Vrouwen kunnen die test doen vanaf de elfde week van hun zwangerschap. NIP-test staat voor ‘niet invasieve prenatale test’. Dit betekent dat het lichamelijk niet erg belastend is voor de moeder: zij hoeft alleen maar wat bloed te laten prikken. Daarin zit namelijk een beetje DNA van de placenta, en dat is weer bijna identiek aan het DNA van het kind.
DNA bevat alle informatie over erfelijke eigenschappen. Lange strengen van opgerold DNA noem je chromosomen. Bijna elk gezond mens heeft twee exemplaren van 23 verschillende chromosomen in zijn cellen zitten, 46 in totaal dus. De NIP-test wijst uit of het kind het juiste aantal chromosomen heeft. Standaard wordt gekeken naar chromosomen met de nummers 21, 18 en 13. Wanneer kinderen daar geen twee, maar drie stuks van hebben, zijn zij belast met het down-, edwards- of patausyndroom. Dat zijn drie ernstige lichamelijke en geestelijke afwijkingen. Bij de laatste twee (edwards- en patausyndroom) is de levensverwachting voor het kind meestal niet langer dan een jaar.
Als ouders het willen, kunnen ze daarnaast hun kind ook op veel andere chromosomale afwijkingen laten testen, zoals afwijkingen waarbij delen van een chromosoom missen of dubbelen. Die kunnen zich uiten in verschillende zeldzame ziekten. Het is met de NIP-test niet mogelijk om heel kleine foutjes (mutaties) op het DNA in de chromosomen op te sporen. Ziektes die zich op één gen bevinden bijvoorbeeld, zoals de mutaties die taaislijmziekte of erfelijke borstkanker veroorzaken.
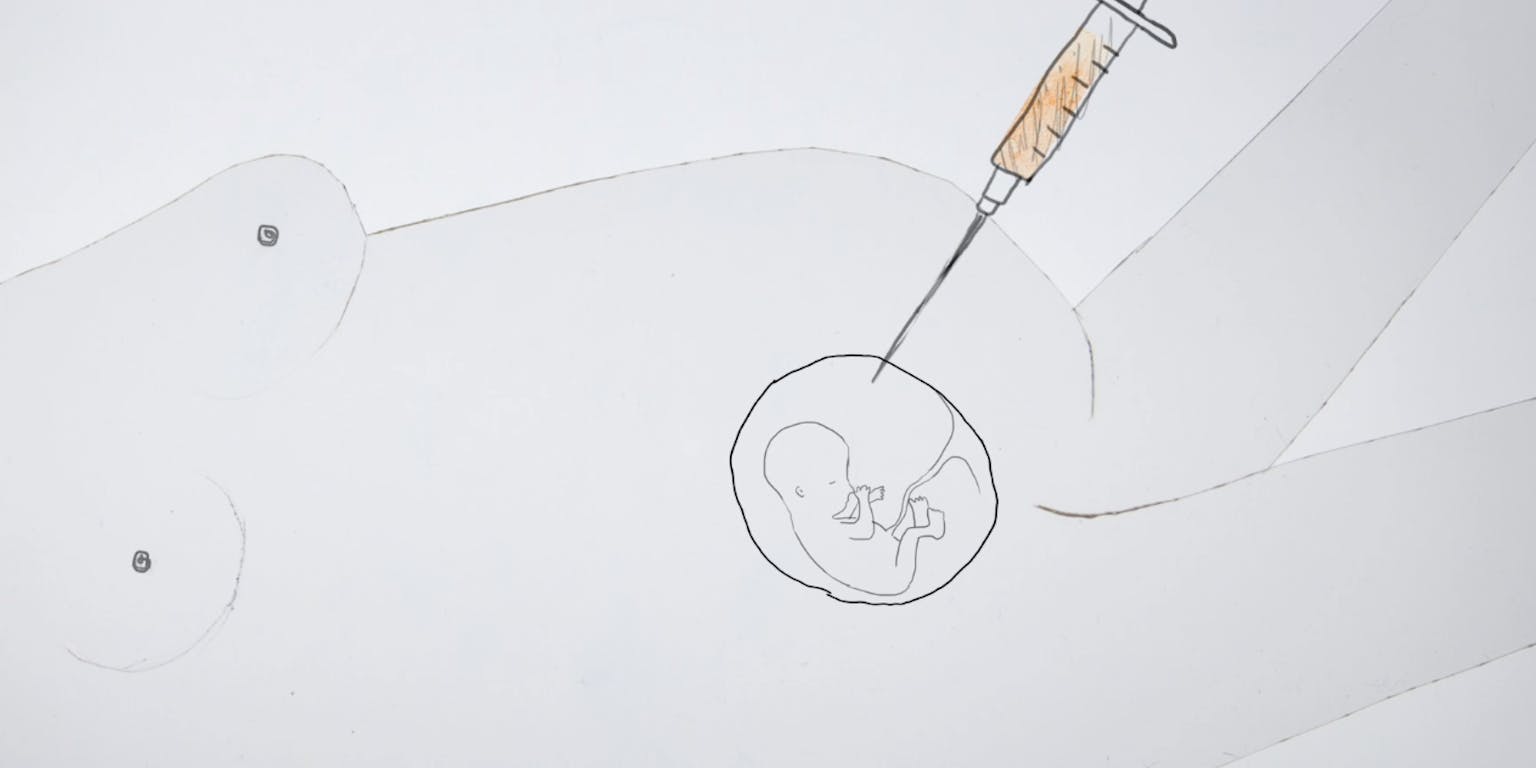
Bij een vruchtwaterpunctie haalt een arts wat vruchtwater uit de baarmoeder van een zwangere vrouw. In dat vruchtwater drijven losse cellen van het kind. In die cellen kan een geneticus zien of het kind een chromosomale of genetische afwijking heeft.
Zaou Vaughan / Fast FactsVlokkentest en vruchtwaterpunctie
Omdat de NIP-test niet voor honderd procent – maar voor 96 procent – nauwkeurig is, kunnen ouders, na een verontrustende NIP-testuitslag, ervoor kiezen om een vlokkentest of vruchtwaterpunctie te doen. Die tests kunnen (erfelijke) ziekten en chromosoomafwijkingen met nauwkeuriger zekerheid bepalen.
Bij een vlokkentest neemt een arts een stukje placenta uit de baarmoeder en bekijkt daarin of het kind afwijkingen heeft in het DNA of in de chromosomen. Bij een vruchtwaterpunctie wordt er met een naald wat vruchtwater uit de baarmoeder gezogen, waarin drijvende cellen van het kind zitten. Daarin kunnen afwijkingen worden opgespoord. Bij deze twee tests kijken onderzoekers naar het aantal chromosomen, naar dubbelingen of stukjes chromosoom die missen. Maar ook kunnen zij meer in detail naar het DNA kijken. Zo kunnen ze afwijkingen in een van de twintigduizend genen opsporen, of kunnen zij gericht zoeken naar erfelijke genetische mutaties die in de familie bekend zijn.
In de twintigste week van de zwangerschap krijgen ouders nog een uitgebreide echo aangeboden. Met behulp van een apparaat dat hoogfrequent geluid uitzendt, kan een echoscopist als het ware door het lichaam van de zwangere vrouw en de baby heenkijken. Omdat organen het geluid weerkaatsen is op een scherm te zien of alle organen en slagaders goed aangelegd zijn. Ligt het hart op de juiste plaats? Heeft het kindje twee nieren en een maag? Ook letten echoscopisten op lichamelijke afwijkingen, zoals een open ruggetje, klompvoeten en het aantal tenen.
Embryoselectie
Een laatste techniek die ingezet kan worden bij het krijgen van een gezond kind is embryoselectie, ook wel Preïmplantatie Genetische Diagnostiek (PGD) genoemd. Met een ivf-behandeling worden er dan in het lab meerdere embryo’s gemaakt, en alleen embryo’s zonder genetische aandoening worden in de baarmoeder geplaatst.
Stellen kunnen voor deze behandeling in aanmerking komen als zij zelf een ernstige erfelijke ziekte hebben, veroorzaakt door een mutatie op een van hun genen. Ook ouders die drager van zo’n mutatie zijn kunnen in aanmerking komen voor embryoselectie. Het dragerschap betekent dat bij hen de ziekte niet tot uiting komt, omdat zij naast het gen met de mutatie ook nog een gen op hun chromosoom hebben dat wel gezond is. Toch kunnen zij het gen met de mutatie wel doorgeven aan hun kinderen, die kans lopen de ziekte wel te krijgen.
Er zijn in Nederland vier plekken waar PGD kan plaatsvinden (Amsterdam, Groningen, Maastricht, Utrecht), maar het genetisch onderzoek dat bij deze behandelingen nodig is vindt plaats in het Maastricht UMC+. “We doen PGD alleen bij ernstige erfelijke aandoeningen die een hoog risico met zich meebrengen voor kinderen”, zegt Christine de Die-Smulders, klinisch geneticus en hoogleraar PGD bij de universiteit in Maastricht. “De ziekte van Huntington bijvoorbeeld, erfelijke borst- en eierstokkanker, cystische fibrose of bloederziekte (hemofilie).”

Bij embryoselectie checken genetici of 8-cellige embryo’s, gemaakt in het lab, een genetische mutatie van de ouders geërfd hebben.
Zaou Vaughan / Fast FactsWaarop selecteer je het beste embryo?
Wanneer bekend is dat de toekomstige ouders een heel ernstige erfelijke ziekte hebben, of drager van die ziekte zijn, gaat een vrouw een IVF-traject in. Door hormoonbehandelingen maakt ze extra veel eicellen aan, die in het lab worden bevrucht met het zaad van de vader. Als het goed is ontstaan daarbij meerdere embryo’s, die allemaal na een dag of drie bestaan uit acht cellen. Bij elk embryo nemen de laboratoriummedewerkers één cel af. Die cel, waaronder de celkern met het DNA, wordt naar het Maastricht UMC+ gestuurd. Daar checken genetici in welke embryo’s de genmutatie aanwezig is.
Meestal blijkt een deel van de embryo’s belast met dezelfde aandoening als de ouders. Die embryo’s krijgen de ziekte ook als ze volgroeien tot mens. Een tweede deel is alleen drager van de ziekte, waardoor zij de ziekte zelf niet ontwikkelen, maar wel kunnen doorgeven aan het nageslacht. En een derde deel heeft de aandoening geheel niet, en is dus vrij van het foutje op het gen dat de ziekte veroorzaakt.
De Die-Smulders plaatst het liefst de gezonde embryo’s uit die laatste groep terug, vertelt zij. Maar in het geval dat er geen embryo’s gevormd zijn zonder de genmutatie, wordt soms besloten een embryo in de baarmoeder te plaatsen die wel drager is van de ziekte. “Dat dat doen we alleen als laatste keus, en in goed overleg met de ouders”, zegt ze. “Hemofilie bijvoorbeeld, heeft bij jongens een ernstig effect. Meisjes hebben er meestal niet zoveel last van, maar ze zijn wel draagster van het gen. Wanneer er dan een jongensembryo is die de ziekte niet heeft, dan plaatsen we die het liefste terug. Meisjesembryo’s die drager van de ziekte zijn, vriezen we in. Mogelijk bieden die de ouders later nog een kans om een kind te krijgen, mocht het met de jongensembryo’s niet lukken.”
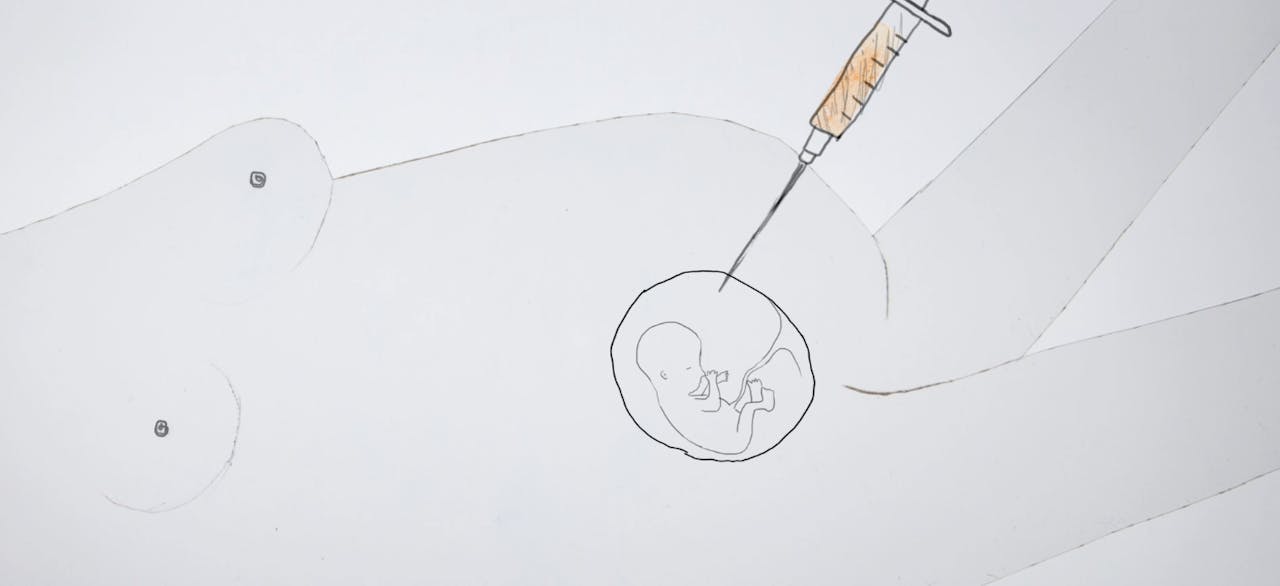
CRISPR-Cas is een technologie die het in de toekomst misschien mogelijk maakt het DNA van embryo’s aan te passen, zodat genen die erfelijke ziektes veroorzaken, gerepareerd kunnen worden.
Zaou Vaughan / Fast FactsCRISPR-Cas in de voortplanting
Maar wat kan de CRISPR-Castechnologie toevoegen aan alle prenatale screeningsmogelijkheden en embryoselectie? In theorie zou een CRISPR-Casbehandeling in te zetten zijn tijdens of net na de kunstmatige bevruchting van een eicel. Wanneer het embryo een paar dagen later uit acht of meer cellen bestaat, kan met PGD gecheckt worden of de DNA-bewerking gelukt is. Er is echter nog veel niet bekend over deze techniek.
De manier waarop de CRISPR-Caseiwitten het beste hun werk kunnen doen in de bevruchte eicel is nog niet bekend. De Chinese onderzoeker Jiankui He (die in november 2018 verklaarde het DNA van twee meisjes te hebben aangepast toen zij nog embryo’s waren) spoot CRISPR-Cas de eicel in, direct nadat hij er de zaadcel in geïnjecteerd had.
Maar Sebastiaan Mastenbroek, klinisch embryoloog aan het Amsterdam UMC, vertelt dat het nog lang niet duidelijk is of He dat wel op het meest optimale moment deed, en of de CRISPR-eiwitten hun werk wel efficiënt hebben kunnen doen. “De DNA-aanpassing is niet gegarandeerd met de injectiemethoden en de eiwitten zoals Jankui He die gebruikte”, zegt hij. Onderzoekers ontwikkelen namelijk steeds meer nieuwe manieren waarop CRISPR-Cas in de eicel terecht kan komen en ook de CRISPR-Caseiwitten zelf kunnen ze steeds verder verbeteren. “Vrijwel wekelijks verschijnen publicaties over nieuw ontworpen en mogelijk efficiëntere en doelgerichtere Crispr-Caseiwitten.”
Ook is nog niet bekend hoe veilig CRISPR-Cas zijn werk doet in menselijke embryo’s. Op korte termijn is CRISPR daarom geen reële optie in het voortplantingstraject, benadrukt Mastenbroek een paar keer. “De bijwerkingen van de techniek zijn nog niet duidelijk, zoals het ontstaan van ‘off target’-veranderingen [onbedoelde en ongewenste veranderingen op andere plaatsen in het DNA, red.]. Het is onbekend wat daar de effecten van zijn. De nieuwe CrispCas-methoden worden overigens verondersteld daar minder last van te hebben, maar dat moet eerst nog maar bewezen worden.”
Mastenbroek denkt dat CRISPR-Cas op de lange termijn wel een plek kan krijgen in het voortplantingstraject. Al geeft hij aan dat vooralsnog voor vrijwel alle patiënten embryoselectie een alternatief voor CRISPR-Cas is. “Alleen niet bij ouders wiens kinderen voor honderd procent belast zullen zijn met een erfelijke ziekte”, zegt hij. “Zoals een ouder die op beide allelen een autosomaal dominante afwijking heeft.” In zo’n geval hebben beide ouders op allebei hun genen een genmutatie die een aandoening veroorzaakt, wat betekent dat zij samen geen kind kunnen krijgen zonder die aandoening. “Maar zo’n situatie heb ik in mijn hele carrière nog nooit meegemaakt”, voegt hij eraan toe.
Ook is het lang niet eenvoudig om elke erfelijke ziekte uit te sluiten met genbewerkingstechnieken. “Bij erfelijke ziektes zijn vaak meerdere genen betrokken en dat is vooralsnog lastig aan te passen bij embryo’s”, vervolgt Mastenbroek. Hij acht de kans groter dat CRISPR-Cas in eerste instantie gebruikt zal worden bij het aanpassen van eigenschappen waarbij maar één gen betrokken is. Maar dat zijn meteen ook de ziekten die je ook al kunt uitsluiten met embryoselectie.