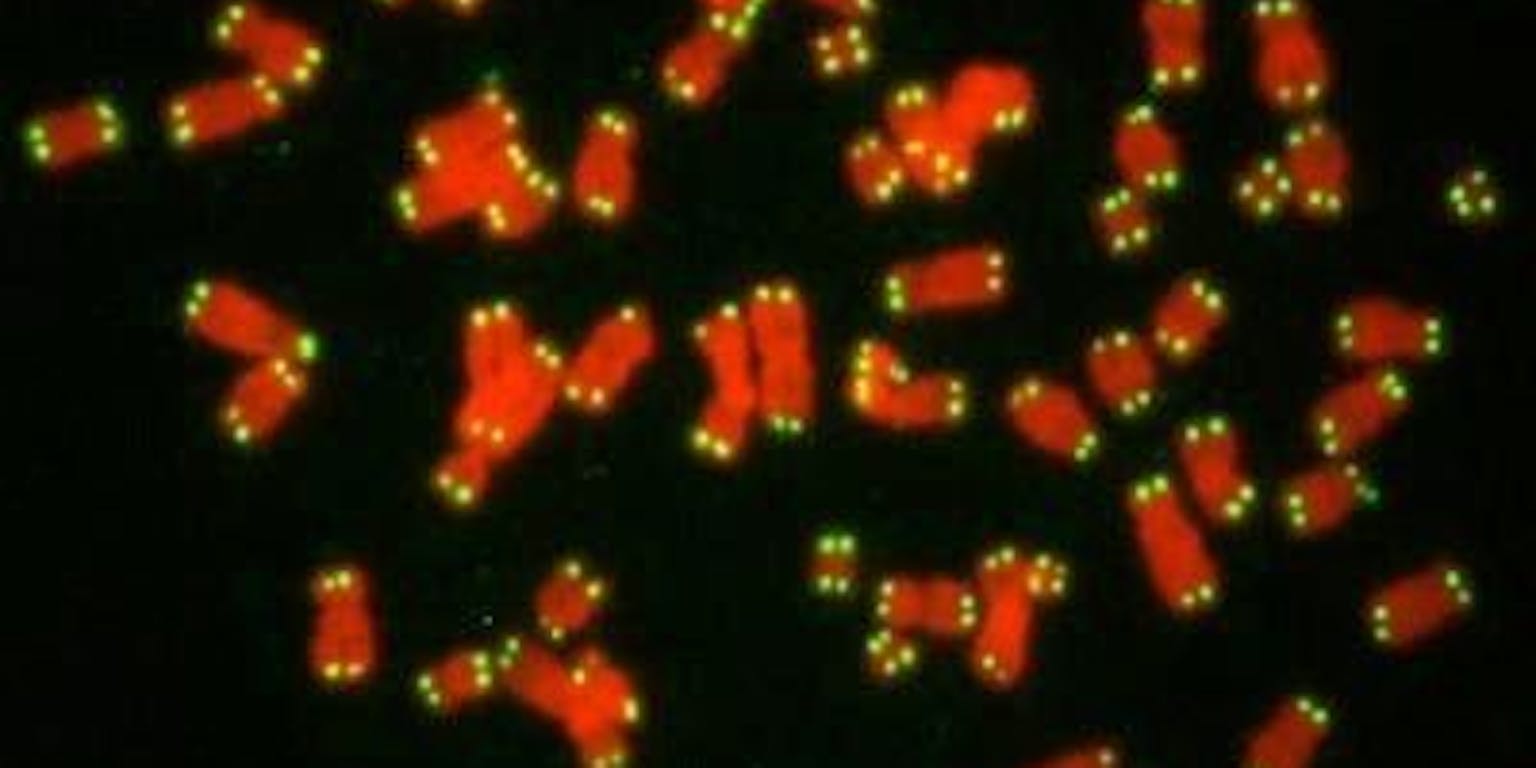
De meeste soorten cellen kunnen maar een beperkt aantal keer delen. Dat komt omdat de uiteinden van de chromosomen, oftewel de telomeren, bij elke deling een stukje korter worden. Maar bij veel vormen van kanker zijn tumorcellen in staat om oneindig vaak te delen. Celbioloog Jacqueline Jacobs onderzoekt hoe telomeerschade kan leiden tot de ontwikkeling van kanker.
Telomeren zitten als een soort kapjes aan de uiteinden van de chromosomen om ze te beschermen. Telomeren voorkomen dat de cel het uiteinde van een chromosoom ziet als een gebroken DNA-eindje dat geplakt moet worden. “Want DNA-reparatie wil je niet aan de chromosoomuiteinden”, zegt Jacqueline Jacobs.
Waarom wil je geen DNA-reparatie aan de chromosoomuiteinden?
“Zonder telomeren zou de cel geen onderscheid kunnen maken tussen het eind van een chromosoom en een gewone breuk midden in het chromosoom. Als de eindjes van de chromosomen gezien worden als DNA-breuk dan wordt het systeem om DNA te repareren actief. Met als gevolg dat de cel de losse chromosomen aan elkaar plakt. Daardoor krijgen de dochtercellen bij de volgende celdeling niet het juiste DNA. Bij elke celdeling wordt het genoom dan herverdeeld. Dat zie je veel bij kankercellen. Kanker ontstaat altijd door genetische veranderingen. Bij de ontwikkeling van kanker gaan tumorcellen dikwijls door een stadium waarbij ze telomeerbescherming verliezen. Dat geeft genoominstabiliteit waardoor het aantal genetische veranderingen toeneemt. En dat kan de tumor helpen om zich verder te ontwikkelen.”
Telomeren worden wel vergeleken met het plastic stukje aan het eind van een schoenveter: zonder dat kapje gaat de veter rafelen. Het telomeer functioneert als telraam voor het aantal celdelingen: tijdens elke celcylclus verliest het een klein stukje DNA aan de uiteinden van alle chromosomen. Een gewone lichaamscel kan daardoor tussen de vijftig en zeventig keer delen. Daarna zijn de telomeren te kort. Bron: Leo Karper
En cellen verliezen die bescherming als de telomeren te kort worden?
“Ja. Bij elke celdeling worden de telomeren een stukje korter. Telomeren bestaan uit korte, herhaalde DNA-sequenties waaraan specifieke eiwitten zijn gebonden. Die eiwitten hebben een belangrijke rol: ze onderdrukken de reparatie van DNA aan de chromosoomuiteinden. Nadat een normale cel zo’n vijftig tot zeventig keer heeft gedeeld zijn de telomeren zo kort dat ze onvoldoende eiwitten kunnen binden. Met als gevolg dat de DNA-reparatie aan het uiteinde van het chromosoom niet meer wordt onderdrukt. Op dat moment legt een gewone cel de celdeling plat. De cel vernietigt zichzelf of hij raakt in een permanente groeistop.”
Maar kankercellen blijven delen. Hoe ontsnappen zij aan die permanente groeistop of apoptose?
“In normale cellen is de tumoronderdrukker p53 actief. Dit eiwit vertelt de cel te stoppen met delen als de telomeren te kort zijn geworden. Maar in beginnende kankercellen zijn genen voor tumoronderdrukkers door mutaties vaak defect of verloren gegaan. Zulke cellen blijven delen, ook zonder de beschermende werking van de telomeren. En op dat moment wordt de DNA-reparatie een probleem. Want dan gaan beginnende kankercellen delen met aan elkaar geplakte chromosomen. Maar naast het feit dat ontwikkelende kankercellen tumoronderdrukkers verliezen, kan 85 tot 90% van de kankercellen oneindig blijven delen doordat ze het enzym telomerase aanzetten. Dat enzym verlengt de telomeren. Gewone cellen kunnen dat niet, omdat ze te weinig telomerase hebben.”
Zijn er aangrijpingspunten in dit proces voor een toekomstige therapie?
“In principe wel. In ons onderzoek proberen we genen en eiwitten te vinden die heel belangrijk zijn op het moment dat de telomeren hun functie verliezen. Dan zou je zo’n eiwit kunnen remmen zodat de chromosomen niet fuseren. Dan wordt het genoom niet instabiel en kunnen we misschien kanker remmen of voorkomen. Maar DNA-reparatie is heel ingewikkeld. Je wilt niet dat remming van zo’n eiwit overal de DNA-reparatie gaat platleggen. Dan krijg je problemen langs een andere weg. Daarom is het belangrijk om de stoffen die wij vinden goed te karakteriseren, zodat we precies weten hoe ze de DNA-reparatie beïnvloeden.”