Bij medische innovaties horen eerste patiënten. Dat ging vroeger wel een stukje makkelijker dan nu. Wanneer is het voor de wetenschap veilig genoeg om embryo-DNA aan te passen?
Wereldnieuws was het in 1978. In een klein ziekenhuis in het Engelse Oldham werd op 25 juli Louise Joy Brown geboren, ’s werelds eerste ivf-baby. In dikke chocoladeletters kopte de Britse krant The Evening News: ‘Meet Louise, the first testtube arrival: SUPERBABE’. Een paginavullende zwart-wit foto van een klein meisje dat met grote donkere ogen nieuwsgierig de wereld inkijkt, leverde het bewijs. Het fotobijschrift: ‘Wide-eyed Louise, 18 uur nadat ze is geboren. Vandaag gaat het goed met haar.”
Spelen voor God
De wereld hield haar hart vast, toen bleek dat een vrouw succesvol zwanger was geworden van een reageerbuisbaby. Een storm van kritiek barstte los. Het was ‘spelen voor God’, zo klonk het uit religieuze hoek, en ook een aantal Amerikaanse wetenschappers waren ervan overtuigd dat er ‘monsters’ geboren zouden worden. De twee pioniers die ‘het wonder’ tot stand hadden gebracht, gynaecoloog Patrick Steptoe en fysioloog Robert Edwards, waren ‘charlatans’. Zelf zegt de inmiddels overleden Edwards hierover in een interview in 2007: “Het was een verdomd groot gevecht. Maar toen ik vocht, vocht ik niet voor mezelf, maar voor mijn patiënten.” En ook zegt hij: “Ik denk dat ik geluk heb gehad - op het juiste moment op de juiste plaats.”
Dat het lukte, was een toevalstreffer. Heel veel was in die tijd nog niet bekend over ivf. En dat betekende heel veel experimenteren, uitproberen, falen en nog een keer proberen. Edwards en Steptoe begonnen hun onderzoek naar onvruchtbaarheid al in de jaren ‘50, en experimenteerden vanaf 1968 met het bevruchten van eicellen buiten de baarmoeder in een reageerbuis. Vanaf 1972 lukt het ook om bevruchte cellen terug te plaatsen bij vrouwen: 282 vrouwen gingen de moeder van Louise voor en kregen een embryo in hun baarmoeder teruggeplaatst. Alle 282 kregen een miskraam.
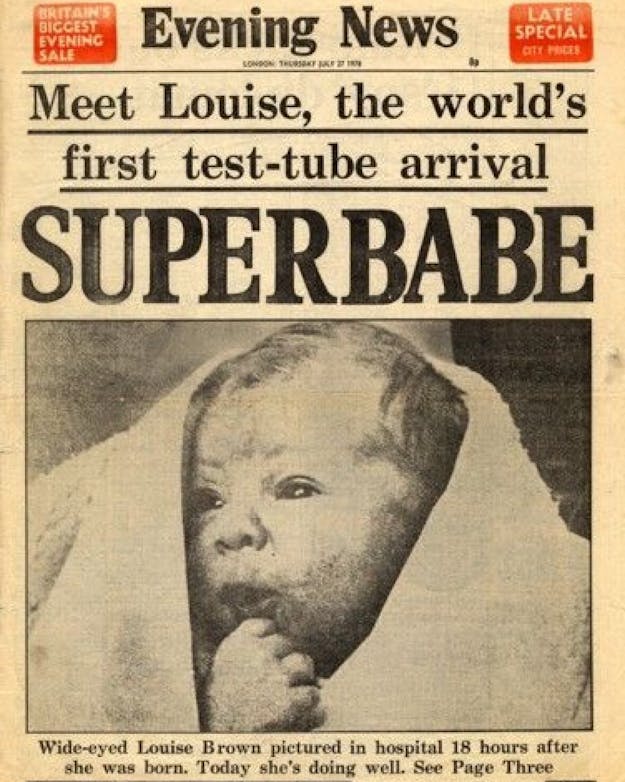
Aankondiging van de eerste ivf-baby in de Britse krant Evening News
Evening NewsVierde patiënt
We kunnen ons er anno 2024 weinig meer bij voorstellen: 8 miljoen ivf-baby’s zijn er sinds Louise geboren, waarvan 14 duizend in Nederland: 1 op de 30 kinderen in Nederland is tegenwoordig een ivf-baby. Maar een moet de eerste zijn. De eerste patiënt die een openhartoperatie kreeg, de eerste patiënt die onder narcose ging, de eerste sikkelcelpatiënt wiens DNA werd behandeld met CRISP-Cas. Bij medische innovaties horen eerste patiënten. Maar hoe weet je nu dat het veilig is? Wat is daarvoor nodig? Zijn er protocollen voor, en zijn die veranderd door de jaren heen?
Als het gaat over ingrijpen in embryo-DNA, kan je deze vraag eigenlijk al niet meer stellen. Die eerste patiënten wiens embryo-DNA is aangepast, die zijn er al. In 2018 kondigde de Chinese wetenschapper He Jiankui de geboorte aan van een tweeling die hij in de embryonale fase genetisch aangepast had met behulp van CRISPR-Cas, en er was toen nog een baby onderweg. De actie van He leidde tot internationale verontwaardiging en een wereldwijde afspraak om geen genetische aanpassingen te doen aan menselijke embryo’s.
Strenge regelgeving
Onderzoekers moeten zich tegenwoordig aan strenge regelgeving houden, vertelt Martina Cornel, hoogleraar Community Genetics & Public Health Genomics bij het Amsterdam UMC, onderdeel van het consortium achter De DNA dialogen. En dat is een goede zaak. Ze verwijst naar een aantal klinische trials die in het verleden zijn stopgezet, omdat de gezondheidsrisico’s voor de patiënten te groot bleken.
Zo was er de proef met gentherapie voor patiëntjes met een ernstige gecombineerde immuunstoornis (SCID), ook wel de ‘bubble boy disease’ genoemd, die in 2002 wegens een verhoogde kans op leukemie werd stopgezet (red. ‘Bubble Boy’ verwijst naar David Vetter, het jongetje dat in 1976 de hoofdrol speelde in de documentaire over zijn eigen leven: The Boy in the Plastic Bubble). En dan waren er de grote schandalen rondom de ‘DES-dochters’ en de ‘Softenon-baby’s’ in de jaren ‘60 en ’70 waarbij de verkeerde medicatie tienduizenden slachtoffers eiste.
Harde lessen
Het waren harde lessen die ervoor zorgden dat er tegenwoordig eerst uitgebreid onderzoek wordt gedaan naar de veiligheid en effectiviteit van een middel of therapie, in de vorm van medische trials, voordat iets op de markt wordt gebracht. Aan de eerste experimentele behandeling met gentherapie die een Nederlandse patiënt met een ernstige erfelijke aandoening kreeg toegediend in 2022, gingen bijvoorbeeld eindeloze onderzoeken vooraf. Komt een geneesmiddel of behandeling uiteindelijk op de markt, dan wordt het goed in de gaten gehouden. Blijken er toch ernstige risico’s te zijn, dan gaat het weer van de markt af. Cornel: “Gezondheidsrisico’s nemen we in de medische wereld hartstikke serieus.”
Hoogleraar biomedische ethiek Guido de Wert aan de Universiteit Maastricht kan dit onderschrijven: “Tegenwoordig is er sprake van een sterk toegenomen probleembewustzijn in de medische wetenschap. Vroeger was het vanzelfsprekend om langs de weg van trial en error van alles meteen in de kliniek te introduceren. Veel onderzoekers hadden de naïeve vooronderstelling dat al die nieuwe technieken eigenlijk niet zo’n kwaad konden.”
Kijk je naar de voorplantingsgeneeskunde, dan speelde er een opmerkelijk dogma op de achtergrond mee, vertelt De Wert: “Men ging er vaak van uit dat als een embryo beschadigd zou zijn, dit naar alle waarschijnlijkheid niet zou leiden tot een zwangerschap, laat staan een geboorte. Als het leidde tot een doorgaande zwangerschap, mocht je erop vertrouwen dat het kind niet beschadigd was. Een heel naïef dogma. Alsof het een kwestie was van alles of niks. Dat dogma is gelukkig verlaten.”

Vroeger bestond het naïeve idee dat een beschadigd embryo niet tot een zwangerschap zou leiden.
Flickr Edwin & Kelly Tofslie, CC BY 2.0Aanrommelen
De Wert is positief over de ‘zorgvuldige implementatie van nieuwe experimentele voortplantingstechnieken, waarbij een zwaar accent wordt gelegd op adequaat pre-klinisch onderzoek naar de effectiviteit en vooral de veiligheid ervan’. Dat geldt echter maar voor een paar landen: “Ik denk dat Nederland, de UK en een paar andere landen het naar verhouding goed doen, maar in veel landen wordt er nog steeds maar wat aangerommeld.”
— Martina Cornel, hoogleraar Community Genetics & Public Health Genomics
In de context van landen die ‘nog steeds wat aanrommelen’, geeft Cornel een voorzichtig antwoord op de vraag wat er volgens haar nodig is voor de ‘eerste’ patiënt wiens embryo-DNA wordt aangepast. In lijn met het standpunt van de Europese beroepsgroepen die pleiten voor een discussie over het traject om de gezondheidsrisico’s voor kinderen te beperken, is ook Cornel voorstander van een zorgvuldig onderzocht medisch scenario. Wil je iets kunnen zeggen over veiligheid of effectiviteit, dan zal je eerst de Embryowet (die het maken van embryo’s voor onderzoek nu verbiedt, red.) moeten verruimen: “Pas dan kan je embryo's speciaal voor onderzoek maken. Dat is de eerste stap.” Stap twee gaat over het onderzoeken of het toepassen van CRISPR-Cas bij een embryo veilig en effectief is. Is het antwoord ja, dan kan je nadenken over een trial, een test: “Pas dan kan je misschien echt kindjes geboren laten worden.”
Politiek proces
Die trial is echter niet mogelijk, omdat de Europese wetgeving dat verbiedt, legt Cornel uit: “Daarvoor zal je eerst de Clinical Trials Regulation moeten veranderen, de EU-verordening voor geneesmiddelenonderzoek.” Tel daarbij op het politieke proces en het zou nog wel eens lang kunnen duren voordat dit scenario werkelijkheid wordt: “Politici hebben hun handen vol aan duizend andere dingen. Bovendien zou het allemaal nog wel eens behoorlijk duur kunnen worden, als je de kinderen die geboren worden ook levenslang wil monitoren en wil kunnen bijsturen als de risico's te groot blijken te zijn. Het zou me niet verbazen dat het via de reguliere wegen in Europa nog twintig jaar duurt voor we de eerste patiënt hebben.”
Tegelijkertijd ziet Cornel een tweede scenario, de commerciële route, eerder werkelijkheid worden: “Vandaag is het nog strafbaar, want er is een moratorium (tijdelijk verbod), maar intussen wordt er toch aan doorgewerkt. Dat gebeurt vooral buiten de universiteiten in praktijken waar wij geen goed zicht op hebben. Als je ergens geld kunt verdienen, wordt het ergens aangeboden. Dingen hoeven medisch gezien niet altijd heel verantwoord te zijn om toch verkocht te worden. Kijk maar naar de polygene risicoscores van embryo’s waarvan we weten dat ze wetenschappelijk niet goed zijn onderbouwd, maar toch worden ze aangeboden in de Verenigde Staten. Het is lastig te voorspellen, maar ik zou me kunnen voorstellen dat het in sommige landen zoals de VS of Mexico, twee keer zo snel gaat als de zorgvuldige medische route.”

