Prarthana Mohanraju bijt zich vast in complexe systemen die DNA bewerken, zoals CRISPR-Cas. “Ik wil het begrijpen.” Haar zoektocht gaat verder. “We zochten in een composthoop naar hittebestendige bacteriën, en vonden een nieuwe DNA-knipper. Ik denk dat we hiermee nog nauwkeuriger DNA kunnen bewerken.”

Prarthana Mahanraju spreekt op de CRISPRcon 2019 over haar onderzoek
CRISPRconOp de CRISPRcon(ferentie), dit jaar in Nederland, komen kenners van over de hele wereld bij elkaar om twee dagen lang te discussiëren en te leren over de mogelijkheden en gevolgen van CRISPR-Cas. CRISPR-Cas is een gereedschap afkomstig uit bacteriën, dat op gerichte plekken in het DNA een knip kan zetten. Op de plek van de knip kunnen onderzoekers de genetische code in (menselijke) cellen veranderen. De toepassingen zijn soms controversieel. NEMO Kennislink sprak met Prarthana Mohanraju van Wageningen University & Research over haar zoektocht naar nieuwe CRISPR-Cassystemen, want de hype is bij Cas nummer negen niet stil blijven staan.
Wanneer hoorde je voor het eerst van CRISPR-Cas?
“Dat was in een college van John van der Oost en Stan Brouns tijdens mijn master in 2012. Ik vond het een heel elegant systeem, maar toen nog erg fundamenteel. We begrepen toen lang niet alles- en nog steeds zijn er aspecten die we niet begrijpen.”
Hoe ben je in Wageningen terechtgekomen?
“Mijn ouders waren verbaasd dat ik al op school wist dat ik biotechnologie wilde studeren. In India, waar ik geboren ben, komt biotechnologie nu langzaam op gang. Ik ging voor mijn master op zoek naar de beste labs. Ik wil complexe systemen in de cel begrijpen, maar ook meteen de vervolgvraag stellen: wat kun je ermee? Wageningen heeft die combinatie. In 2015 startte ik mijn promotie bij John van der Oost, hoogleraar microbiologie. Mijn thesis is momenteel zo goed als af.
Is het systeem complexer dan je dacht?
Ja. Toen ik hoorde over CRISPR-Cas, wisten we bijvoorbeeld nog niet van het bestaan van anti-CRISPR-eiwitten. CRISPR-Cas is het verdedigingsmechanisme van een bacterie tegen virussen. Als een virus de bacterie infecteert, injecteert het virus genetisch materiaal. De bacterie verweert zich tegen het virus door dit met CRISPR-Cas kapot te knippen. Virussen hebben op hun beurt weer een verdedigingsmechanisme bedacht, zij blokkeren het bacterieverdedigingsmechanisme: een anti-CRISPR. Het is een wapenwedloop tussen de bacterie en het virus.”
Kunnen we anti-CRISPR ook gebruiken voor onderzoek?
“Het bestaan ervan is pas een paar jaar geleden ontdekt. Daar wordt wel aan gewerkt, want het heeft de potentie om als aan-uitschakelaar te dienen voor CRISPR-Cas. Zo kun je veel beter sturen wanneer en waar je DNA wilt knippen.”
Op de conferentie vertelde je dat jullie een nieuw eiwit vonden dat DNA knipt, ThermoCas9. Thermo betekent warmte, het knipt bij warmte. Hoe vind je zo’n nieuw Cas-eiwit?
“Dat is soms puur toeval. Mijn collega Tijn Daas doorzocht voor een ander onderzoek een composthoop in Ede. Hij was op zoek naar thermofiele (hittebestendige) micro-organismen. De composthoop was de place-to-be, want daar broeit het lekker. Terug in het lab bleek het geslaagd, hij had zo’n organisme te pakken. De DNA-code was bekend en door die af te lezen kan ik zien of het organisme zo’n CRISPR-verdedigingssysteem heeft. Dat leek zo te zijn! Vervolgens onderzocht ik met collega’s Loannis Mougiakos en Elleke Bosma wat dit knipeiwit allemaal nodig heeft om te functioneren. Het verbaast je niet dat het werkt bij hoge temperaturen, maar het optimum lag bij wel 55 graden.”
Wat is het voordeel ten opzichte van bestaande Cas-eiwitten?
“Het werkt het meest efficiënt bij hoge temperaturen. Breng je de temperatuur naar beneden dan werkt het heel moeizaam, maar wordt het wel preciezer. Het lijkt dus nog nauwkeuriger DNA te kunnen bewerken. Een ander voordeel is dat het een kleiner eiwit is, je kunt het daardoor makkelijker in de juiste cel brengen. Ten derde komt ThermoCas9 uit een bodembacterie, die geen ziekteverwekker is bij mensen. De meest bekende Cas9 wel, waardoor er misschien een afweerreactie op gang komt als je het gebruikt in een therapie.”

In een micro-organisme uit een composthoop in Ede bleek een toen nog onbekend CRISPR-Cassysteem te zitten
CC BY-NC 2.0 Jon Anderson via FlickrHeeft ThermoCas9 ook nieuwe toepassingen?
“Hittebestendige bacterieën zijn handig voor de bioraffinaderij, omdat ze functioneren bij hoge temperaturen. Bij het maken van biobrandstof gaat normaal veel energie verloren aan het verhogen en verlagen van de temperatuur. Je moet de biomassa verhitten tot zestig of zeventig graden zodat enzymen de biomassa afbreken, dan weer laten afkoelen tot 37 graden om gemodificeerde bacteriën hun werk te laten doen, om het vervolgens weer te verhitten om er gas uit te krijgen. Als de bacterie op die zeventig graden werkt hoef je maar een keer te verhitten. Tot nu toe waren er geen goede middelen om een thermofiele bacterie aan te passen, maar met ThermoCas9 is dat een heel stuk simpeler.”
Heb je nog andere varianten onderzocht?
“Ja, ik wilde heel graag weten hoe Cas12a werkt. Het eiwit werd in 2015 voor het eerst beschreven. Het werkte anders dan het welbekende Cas9. We wisten dat Cas12a alleen een gids nodig heeft om te functioneren, terwijl Cas9 daarnaast nog een helper-gids nodig heeft. We hadden geen idee hoe Cas12a aan die gids kwam. Er kwam geld vrij om dat te onderzoeken, het was heel spannend.”
Waarom was het zo spannend?
“We wisten er nog maar weinig van. Tijdens het onderzoek bleek Cas12a zelfs heel anders te werken dan we dachten! Het kan zijn eigen gidsen maken. Waar Cas9 een gids en een helper nodig om de juiste knipplaats in het DNA te zoeken, en voor elke knip die je wilt uitvoeren moet je dit opnieuw maken. Cas12a kan simpelweg zijn gidsen van een grote ketting met alle gidsen afknippen. Zo kun je verschillende DNA-knips in één onderzoeksstap uitvoeren. Cas12a pikt zelf elke keer een andere gids uit. Dit bespaart veel tijd als je meerdere genen wilt verwijderen voor onderzoek.”
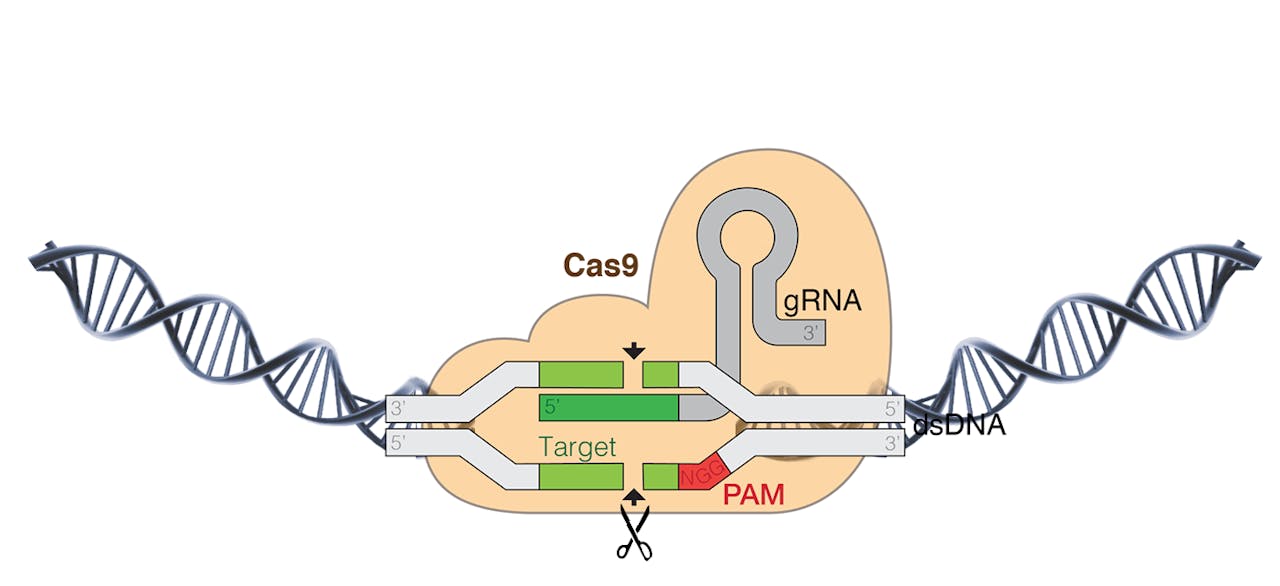
Gids-RNA (grijs) brengt het Cas-eiwit dat DNA knipt (geel) naar de juiste plek op het DNA. Hiermee kunnen onderzoekers een gen verwijderen of toevoegen.
Wikimedia Commons, Marius Walter, bewerkt door KennislinkHebben we het dan, of zijn er nog meer CRISPR-Cassystemen?
“Er zijn al veel verschillende systemen. Ik denk dat we de meeste ondertussen kennen. Maar het zou me niks verbazen als we binnenkort nog een nieuw systeem ontdekken.”
Zijn daarbij nog varianten die we voor een specifieke toepassing gebruiken?
“Cas13, ontdekt door Feng Zhang, is een bijzondere. Dit eiwit maakt geen knip in DNA (opslag van erfelijke informatie op een dubbele streng), maar in RNA (dat maar tijdelijk genetische informatie draagt op een enkele streng). Je kunt dus ook RNA bewerken. Sinds kort kent dit ook een geheel nieuwe diagnostische toepassing. Hierdoor is het mogelijk om een zika- of ebola-infectie aan te tonen in speeksel.”
“En een van de nieuwste technieken, die momenteel heel populair is, is base editing. Waar je normaal het DNA doormidden knipt om veranderingen aan te brengen, kun je met base editing heel nauwkeurig een basenpaar veranderen. Deze techniek maakt geen rigoureuze knip. Bij veel erfelijke ziekten zit de oorzaak in maar één basenpaar.”
Wat is de beste toepassing van CRISPR-Cas, nu of in de toekomst?
“In mijn ogen is dat het genezen van erfelijke aandoeningen. Het defect zit in de genen, als je dat weet aan te passen red je levens. CRISPR is hier perfect voor. Mits het uiteraard eerst grondig onderzocht is.”
Word je ontmoedigd door toepassingen van CRISPR zoals die van He Jiankui, die door een groot deel van de wetenschappers worden verafschuwd?
“Nee, zeker niet. Het was slecht om te horen wat hij heeft gedaan, maar ik laat mij niet ontmoedigen. Ik doe dit voor goede doeleinden en hoop dat er uiteindelijk mensen mee genezen.”

