De nieren behoren tot de meest complexe organen van ons lichaam. Beschadigde nieren repareer je dan ook niet zomaar even. Dankzij de regeneratieve geneeskunde zijn er nu technieken beschikbaar om niercellen te kweken. Het uiteindelijke doel is om een biologische kunstnier te maken die de functie van beschadigde nieren kan overnemen.
Binnen het onderzoeksproject BioKid, dat in de zomer van 2014 afliep, hebben wetenschappers hard gewerkt om de eerste stap te zetten richting een biologische kunstnier. “De techniek is nog volop in ontwikkeling”, vertelt Roos Masereeuw, farmacologe aan het Nijmeegse Raboudumc en als onderzoekster betrokken bij het BioKid-project. “Het lukt nu al heel aardig om niercellen te laten groeien op holle buisjes. En we kunnen het transport van afvalstoffen van de ene kant (de ‘bloedkant’ waar straks afvalstoffen worden opgenomen) naar de andere kant (de kant van het ‘afvalvat’ waar de afvalstoffen straks terecht moeten komen) meten. Het idee is om uiteindelijk verschillende buisjes aan elkaar te koppelen zodat je een soort reactor krijgt die in staat is om afvalstoffen op te ruimen.”
170 liter voorurine
Want dat is een van de belangrijkste functies van de nieren. Zij zuiveren het bloed door ongewenste stoffen, zoals afvalstoffen, te verwijderen. Dit gaat in twee stappen: een actieve stap en een passieve stap.
Tijdens de passieve stap wordt water met daarin opgeloste stoffen uit de bloedvaten gefilterd. Bloedcellen en grote eiwitten blijven in het bloed achter. Water en kleine opgeloste stoffen komen terecht in het kapsel van Bowman, het opvangvat van de nier. Alles wat in het opvangvat terecht komt, noemen we voorurine. Een volwassen mens maakt daar dagelijks ongeveer 170 liter van aan. Gelukkig hoef je die 170 liter niet allemaal uit te plassen.
Onder het opvangvat hangen namelijk de nierbuisjes, die uit de voorurine nog een heleboel belangrijke stoffen terugwinnen. Zoals bijvoorbeeld water, zout en glucose. Daarnaast kunnen ook stoffen die in het bloed zijn achtergebleven in deze fase nog actief worden uitgescheiden. Uiteindelijk blijft er ongeveer zes procent van de voorurine over. Dit is urine en wordt getransporteerd naar de blaas.
Vergiftigen
Als het weefsel beschadigd raakt, heeft dat gevolgen voor de zeeffunctie van de nier. Het bloed wordt dan niet meer goed gezuiverd. Bij beperkte schade kan de nier zichzelf nog herstellen met bestaande cellen. Maar op een gegeven moment lukt dat niet meer. De patiënt wordt dan afhankelijk van nierdialyse. Twee tot drie keer per week moet hij of zij een paar uur doorbrengen in het ziekenhuis of een speciale kliniek om het bloed te laten zuiveren door een apparaat. Afvalstoffen, water en zouten worden daarbij via een membraan uitgewisseld tussen het bloed van de patiënt en de spoelvloeistof in het dialyseapparaat.
Op zich mooi dat zo’n behandeling mogelijk is, maar ideaal is het zeker niet. Masereeuw: “Aan de techniek van dialyse is de afgelopen veertig jaar niet veel veranderd of verbeterd. Het probleem is dat er na behandeling nog veel afvalstoffen achterblijven. De patiënt is zichzelf dus als het ware aan het vergiftigen. Een biologische kunstnier zou de afvalstoffen op kunnen ruimen die na dialyse nog achterblijven.”
Aan de techniek van nierdialyse is de afgelopen veertig jaar niet veel veranderd of verbeterd.
Wikimedia Commons, Anna Frodesiak via CC0Geavanceerder filter
Medisch bioloog Jasper Boomker werkt als programmamanager bij de Nierstichting, een van de financiers van het BioKid project. “De biologische kunstnier is een toevoeging op dialyse”, vertelt hij. “We vervangen het huidige filter als het ware door een geavanceerder filter. Maar dialyse verwijdert niet alleen afvalstoffen. De spoelvloeistof in het dialyseapparaat zorgt bijvoorbeeld ook voor het corrigeren van de zoutbalans. Dit is in een biologische kunstnier niet na te bootsen.”
Volgens Boomker is de ontwikkeling van een biologische kunstnier technisch waarschijnlijk wel mogelijk, maar zijn toepassingen van het apparaat nog niet reëel. Vooral vanwege de kosten. “De dialysemembranen die nu als filter gebruikt worden, kosten 7 of 8 euro per stuk. Maar de geavanceerdere membranen kosten al snel 3000 euro per stuk”, legt hij uit. Voor een behandeling die minstens een keer per week uitgevoerd moet worden, loopt dat aardig in de papieren. Zorgverzekeraars zullen deze hoge kosten niet accepteren.
Temperatuurswitch
Een tweede probleem ligt bij het kweken van niercellen. Het is niet eenvoudig om snel grote hoeveelheden niercellen beschikbaar te krijgen. Masereeuw en haar collega’s hebben daar inmiddels wel wat op gevonden. “In ons lab gebruiken we niercellen uit de urine van gezonde mensen”, vertelt ze. “Tijdens het plassen komen er altijd wel een paar cellen mee. Die cellen kun je isoleren en in kweek brengen. Na een week heb je dan een hoopje cellen, maar dit proces is wel eindig. Op een gegeven moment stoppen de cellen met groeien. Wij hebben de cellen behandeld en twee verschillende genen ingebracht: een gen dat ervoor zorgt dat de groei doorgaat en een temperatuurswitch.”

In de urine zitten altijd wel een paar niercellen die je kunt isoleren en daarna in kweek kunt bbrengen.
Wikimedia Commons“Wat je dan krijgt, zijn niercellen die zich bij 33 graden Celsius gewoon vermenigvuldigen en bij 37 graden Celsius veranderen in gespecialiseerde niercellen die in staat zijn om afvalstoffen uit te scheiden.” Boomker: “Het is nog maar de vraag of we zulke cellen met een temperatuurswitch ooit op een verantwoordelijke manier kunnen gebruiken voor de behandeling van patiënten.”
De ontwikkeling van de biologische kunstnier gaat door, nu binnen het onderzoeksproject BIOART, dat hiervoor een Europese subsidie heeft ontvangen. “Op dit moment is het de vraag in hoeverre de biologische kunstnier straks ook geschikt is voor toepassing in patiënten. Het BIOART project moet daar antwoord op geven. Is dit de way to go of kunnen we ons beter ergens anders op richten?”, legt Boomker uit.
Gekweekte varkensnier
Bijvoorbeeld op het kweken van een compleet nieuwe nier. “Wetenschappers hebben de afgelopen jaren laten zien dat het mogelijk is om, weliswaar rudimentaire, miniorgaantjes te kweken”, zegt Boomker. “Dit zijn volledig biologische systemen die worden gekweekt vanuit stamcellen of embryonale weefsels. In het embryo vormen de nieren zich door samenspraak van twee embryonale structuren. Door die weefsels in een kweekbakje bij elkaar te brengen, ontstaan rudimentaire miniorgaantjes. Bij ratten is het al gelukt om deze orgaantjes te implanteren onder het nierkapsel. Daar groeiden ze uit tot nieuwe nierachtige structuren. Het is de vraag of deze methode ook geschikt is om een beschadigde nier te repareren of te vervangen. Maar het is een mooi voorbeeld dat laat zien dat je slim gebruik kunt maken van wat de natuur al heeft bedacht.”
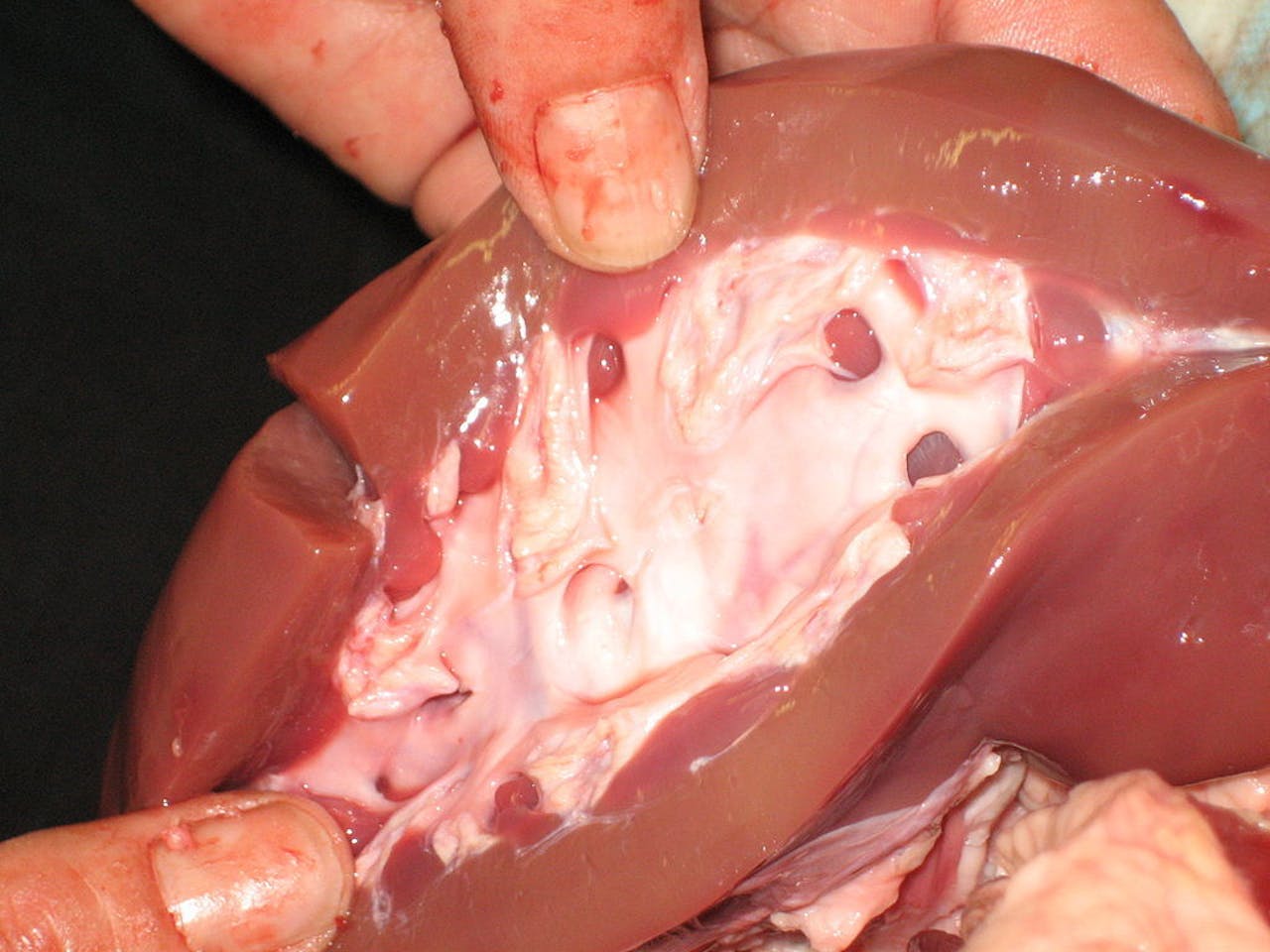
Varkensnier. Het is mogelijk om zo’n nier helemaal leeg te halen en daarna opnieuw te vullen met menselijke cellen.
Wikimedia CommonsEen andere benadering die in opkomst is, is het “verbouwen” van een varkensnier tot een nier met menselijke cellen. Hierbij worden alle cellen uit een varkensnier gehaald. Wat dan overblijft is een gelei-achtig geraamte waarin dan weer menselijke cellen gekweekt kunnen worden.
Helaas functioneren dergelijke nieren maar één of twee uur. Daarna ontstaan er bloedklonters in het orgaan en kan het zijn werk niet meer doen. Anthony Atala, pionier op het gebied van regeneratieve geneeskunde en werkzaam aan het Amerikaanse Wake Forest Institute for Regenerative Medicine, heeft zeer recent een methode ontwikkeld waardoor de bloedstroom door de nier op gang blijft. Met die methode kon hij gekweekte varkensnieren, die ongeveer even groot zijn als een menselijke nier, vier uur lang in leven houden. Dat is voor toepassingen nog steeds niet lang genoeg, maar vooruitgang is er zeker.
Zelfherstel
Ook al zijn er nog veel hobbels te nemen, Boomker gelooft wel dat het ooit gaat lukken om een vervangende nier te kweken. “Het genezen van nierziekten zal op korte termijn geen realiteit zijn, maar ik denk dat er binnen tien tot vijftien jaar wel een aantal belangrijke stappen zijn gemaakt.” Masereeuw denkt niet dat het kweken van een nieuwe nier realistisch is. “Een complete nier bevat zo’n twintig verschillende celtypen die ook nog eens allemaal met elkaar communiceren. Misschien dat je dit met kweken ook voor elkaar kunt krijgen, maar het zal heel wat voeten in aarde hebben.”
Zij ziet meer in een aanpak waarbij de nier gestimuleerd wordt zichzelf te herstellen. “Voor het hart is al een behandeling met stamcellen beschikbaar. Dat is echt een enorme doorbraak geweest. Wij kunnen daar bij het behandelen van andere organen veel van leren. In nierweefsel zijn ook al eens stamcellen toegediend, maar die resultaten zijn nog niet hoopvol. We krijgen een steeds beter beeld van de factoren die een rol spelen bij het zelfherstel van de nier. Dat herstel weer aanzetten moet dus mogelijk zijn.”