Eind mei werd de landelijke campagne ‘doodgezwegen.nl’ gelanceerd, een campagne om geld op te halen voor onderzoek naar de ziekte van Huntington. Doel is om binnen tien jaar een medicijn tegen deze ernstige erfelijke ziekte te ontwikkelen. Hoe ver is het onderzoek en hoe realistisch is dat doel? NEMO Kennislink zocht het uit.
Er rust een taboe op de ziekte van Huntington, een erfelijke aandoening waarbij patiënten binnen vijftien tot twintig jaar in een kasplantje veranderen. Veel mensen weten niet dat de ziekte in hun familie rondgaat, tot het moment dat ze er zelf mee te maken krijgen (meestal rond het veertigste levensjaar).
Veel mensen willen het ook helemaal niet weten. En geef ze eens ongelijk. Kinderen van een ouder met de ziekte van Huntington hebben zelf vijftig procent kans om ziek te worden. En kunnen zich daar vanaf hun achttiende op laten testen. Je weet dus wat je te wachten staat en het heeft gevolgen voor je hypotheek, verzekering, carrière en relatie. Maar er is geen geneesmiddel, er is helemaal niks. Daarom wordt de ziekte vaak verzwegen.
Klonterend eiwit
“Naar schatting zijn er in Nederland ongeveer tweeduizend patiënten met de ziekte van Huntington”, vertelt Eric Reits, celbioloog aan het Academisch Medisch Centrum (AMC). “Daarnaast zijn er nog zo’n tienduizend risicodragers, mensen die nog niet ziek zijn maar dat in de toekomst mogelijk wel worden. Het gaat dus om een best grote groep.”
De ziekte van Huntington kenmerkt zich door een combinatie van symptomen die lijken op die van de ziekte van Alzheimer, de ziekte van Parkinson en ALS. Patiënten krijgen te maken met bewegingsstoornissen, cognitieve problemen en emotionele problemen. De ziekte is volledig erfelijk. Reits: “Patiënten hebben een mutatie in het DNA dat codeert voor het huntingtine-eiwit. Door die mutatie wordt het eiwit heel veel langer en gaat het klonteren.”
Nederlandse wetenschappers zoeken naar een medicijn dat zich richt tegen het schadelijke huntingtine-eiwit. Via de landelijke campagne doodgezwegen.nl (zie kader) wordt geld opgehaald voor drie veelbelovende onderzoekslijnen.
Minder schadelijk
De eerste onderzoekslijn probeert de aanmaak van het schadelijke huntingtine-eiwit tegen te gaan. Willeke van Roon-Mom, moleculair biologe aan het Leids Universitair Medisch Centrum (LUMC) legt uit: “DNA wordt omgezet in boodschapper RNA en aan de hand daarvan wordt een eiwit gemaakt. We kunnen het boodschapper RNA zo veranderen dat er geen schadelijk huntingtine-eiwit meer gemaakt wordt of dat het gemaakte eiwit minder schadelijk is. Deze methode hebben we in Leiden eerder ontwikkeld voor de ziekte van Duchenne.”
Om te voorkomen dat er schadelijk eiwit wordt gemaakt, zou je de mutatie in zijn geheel uit het DNA kunnen verwijderen. “Maar bij Huntington zit de verandering helemaal aan het begin van het DNA. En daarmee hebben we net pech, want dat maakt het technisch heel lastig om de mutatie eruit te halen”, zegt van Roon-Mom. Wat wel kan, is het schadelijke eiwit minder schadelijk maken. “We hebben in de afgelopen jaren ontdekt dat het lange, schadelijke huntingtine-eiwit in stukjes wordt geknipt. En juist die kleine stukjes zijn toxisch. We proberen nu de code voor de knipplaatsen uit het boodschapper RNA te halen, zodat het schadelijke eiwit niet meer in kleinere stukjes geknipt wordt.”
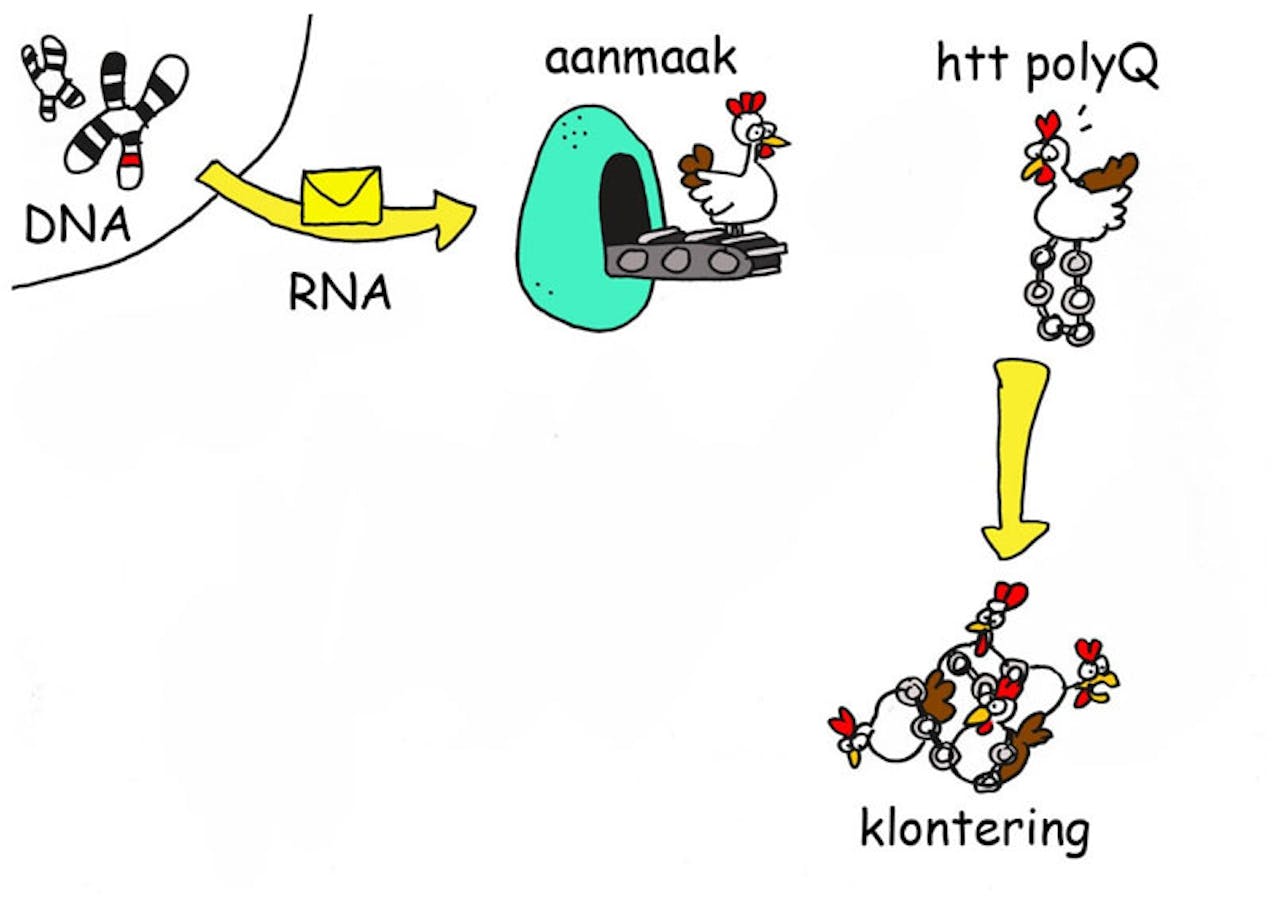
De aanmaak van het schadelijke huntingtine-eiwit. DNA wordt omgezet in boodschapper RNA. Dit boodschapper RNA wordt afgelezen en aan de hand daarvan wordt het eiwit gemaakt. Door een mutatie in het DNA ontstaat er bij het vertalen naar eiwit een verlenging (htt polyQ). Die verlenging zorgt ervoor dat het eiwit gemakkelijk gaat klonteren.
Eric ReitsOm zulke veranderingen aan te brengen, ontwerpt van Roon-Mom moleculen die heel specifiek het huntingtine-eiwit kunnen herkennen. Maar daarmee zijn nog niet alle problemen opgelost. Patiënten maken naast het schadelijke huntingtine-eiwit namelijk ook het ‘gewone’ huntingtine-eiwit aan. En dat gewone eiwit vervult allerlei belangrijke functies. Van Roon: “We hebben gezien dat embryo’s van muizen zonder het huntingtine-eiwit niet overleven. Ongeveer veertig procent van de normale huntingtine-productie heb je minimaal nodig.” Het is dus de kunst om de productie van het gewone huntingtine-eiwit hoog genoeg te houden en tegelijkertijd de productie van het schadelijke huntingtine-eiwit omlaag te brengen.
Chaperonnes
De andere twee onderzoekslijnen richten zich niet op de genetische code, maar meer op het schadelijke eiwit zelf. Harrie Kampinga, celbioloog aan het Universitair Medisch Centrum Groningen (UMCG), probeert te voorkomen dat het schadelijke eiwit kan klonteren. Dit doet hij met behulp van chaperonne-eiwitten, eiwitten die van nature door cellen worden gemaakt om verkeerd gevouwen eiwitten te hervouwen.
“In 2010 hebben we een screen gedaan en toen vonden we een kleine klasse van chaperonne-eiwitten die heel effectief de klontering van het verlengde stukje van het schadelijke huntingtine-eiwit tegen kunnen gaan”, vertelt Kampinga. “We willen nu gaan kijken wat er gebeurt als we de expressie van die chaperonne-eiwitten verhogen.” Dat gaat niet zonder slag of stoot. Bijwerkingen zijn een risico. “Als we chaperonnes tot overexpressie brengen bij embryo’s van muizen worden deze niet geboren. Aan de andere kant, als we chaperonnes alleen in de hersenen activeren, zien we geen nadelige effecten bij volwassen muizen”, legt Kampinga uit.
Hybride molecuul
“Toch moeten we wel uitkijken. ‘Broertjes’ van de eiwitten die wij willen activeren komen hoog tot expressie in tumorstamcellen. Dat is ook logisch, omdat kankercellen veel eiwitten moeten aanmaken om snel te kunnen groeien. Als je meer vouwingscapaciteit aanbiedt en de chaperone-machine harder laat werken, is de kans op kanker groter. Er is zeker rook, maar of er ook vuur is weet ik op dit moment nog niet.”
Mocht directe verhoging van expressie van chaperonne-eiwitten geen succes zijn, dan heeft Kampinga een alternatief op de plank liggen. “We proberen hybride moleculen te maken, bestaande uit het werkzame deel van een chaperonne-eiwit en een drager-molecuul dat in staat is om door de bloed-hersenbarrière heen te gaan.” Deze aanpak heeft één groot voordeel; het is specifieker dan verhoging van expressie. “Het is heel moeilijk om een stofje te vinden dat de expressie van één eiwit verhoogt. Bij verhoging van expressie worden altijd meerdere spelers hard of zacht gezet, met alle mogelijke bij-effecten van dien.”
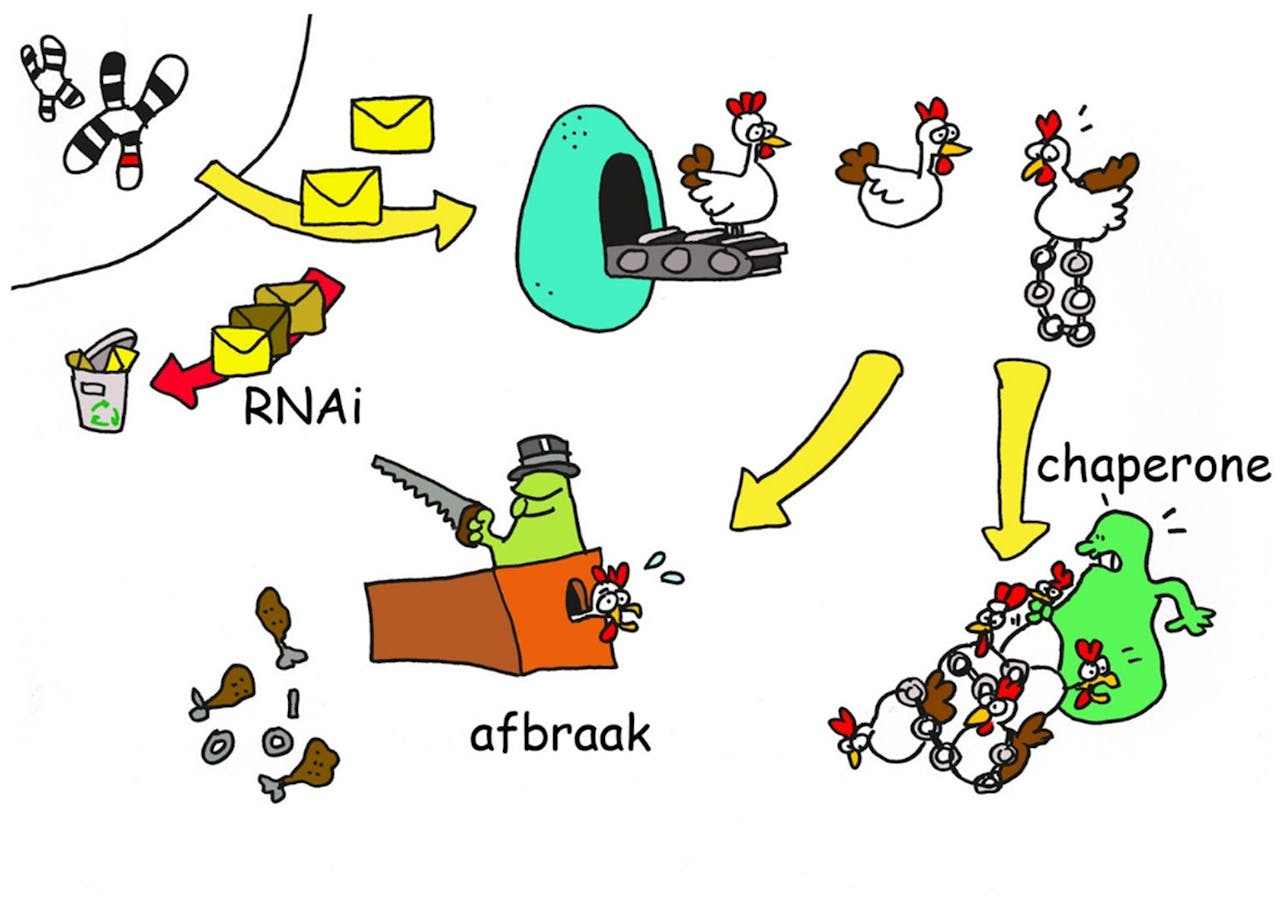
In deze cartoon zijn de drie onderzoekslijnen van het campagneteam Huntington samengevat. Willeke van Roon-Mom probeert het boodschappermolecuul (RNAi) zo aan te passen dat het eiwit minder schadelijke wordt. Eric Reits probeert de afbraak van het klonterende huntingtine-eiwit te bespoedigen en Harrie Kampinga probeert met chaperone-eiwitten te voorkomen dat het schadelijke eiwit gaat klonteren.
Eric ReitsVuilnismannen passen zich aan
De derde onderzoekslijn binnen de campagne wordt geleid door Reits zelf en richt zich op de afbraak van het klonterende huntingtine-eiwit. “We hebben heel lang gedacht dat vuilnismannen in de cellen het schadelijke eiwit niet af kunnen breken, omdat zij vast komen te zitten in de klonteringen”, vertelt hij. “Maar de vuilnismannen hebben geen last van het schadelijke eiwit. Ze zijn gewoon actief. Het probleem is dat het schadelijke huntingtine-eiwit door de mutatie niet meer herkend wordt. Er komt geen ‘afvalsticker’ op en dus wordt het door de vuilnismannen genegeerd. En dan krijgt het kans om zich op te hopen.”
Reits deed in de afgelopen jaren opvallende observaties in tests met cellen. Zo zag hij bijvoorbeeld dat vooral bepaalde hersencellen er last van hebben, terwijl het schadelijke huntingtine-eiwit in alle lichaamscellen wordt gemaakt. “De vuilnismannen van gezonde cellen lijken zich aan te passen om het schadelijke eiwit beter te kunnen opruimen. Ze pakken als het ware een ander stofzuigermondje. Je ziet dan ook geen klontering. In aangetaste hersencellen valt het stofzuigermondje er juist af. Daarnaast denk ik dat er in de aangetaste cellen te weinig enzymen actief zijn die het huntingtine-eiwit herkennen. We willen nu weten welke enzymen het schadelijke eiwit kunnen herkennen en afbreken en hoe we die kunnen activeren.”
Binnen tien jaar…
De campagnewebsite is optimistisch. Binnen tien jaar zou er een medicijn tegen de ziekte van Huntington moeten zijn. Maar is dit ook realistisch? Reits: “We zijn er vanuit gegaan dat de voorgestelde onderzoekslijnen zo’n drie tot vijf jaar duren. Doel is dat we daarna kunnen zeggen ‘dit of dat enzym moeten we activeren of aanpassen’ en dan gaan we op zoek naar een medicijn dat dit zou kunnen. Eigenlijk zijn we daar nu ook al mee bezig. In samenwerking met een groot farmaceutisch bedrijf testen we of bestaande medicijnen de ophoping van schadelijk huntingtine-eiwit tegen kunnen gaan. Binnen vijf jaar hopen we een goede kandidaat te hebben en dat wordt dan getest in proefdieren en mensen. Dit duurt ook minimaal vijf jaar, maar bij een bestaand medicijn kan het veel sneller gaan.”
Van Roon-Mom is wat huiverig voor het noemen van jaartallen. “Als alles goed gaat, kan het inderdaad binnen tien jaar. Maar medicijnonderzoek gaat in fases en als er een stap in een fase niet goed gaat ben je zo twee tot drie jaar langer bezig. We hebben dit ook gezien bij de ziekte van Duchenne. Ik vind het ook oneerlijk naar patiënten toe, want die klampen zich er wel aan vast. Natuurlijk wordt met hen besproken hoe reëel de kansen zijn, maar vaak blijft toch hangen wat iemand wil horen.”


