Een nieuwe generatie alzheimermedicijnen richt zich veelal op het opruimen van een belangrijk eiwit in de hersenen. Maar de ontdekking van eiwitpatronen leidt wellicht tot nog gerichtere medicijnen.
Na meerdere positieve berichten uit de Verenigde Staten over nieuwe goedgekeurde alzheimermedicijnen, gloort in Nederland hoop. Mogelijk komen deze geneesmiddelen ook in Europa beschikbaar - de Europese medicijnwaakhond EMA buigt zich er nog over. Belangrijk nieuws, maar zeker nog geen eindstation: na deze eerste generatie medicijnen volgen nog weer nieuwere middelen.
Want op zichzelf zullen deze medicijnen niet de oplossing zijn voor de ongeveer 200 duizend Nederlanders met de hersenaandoening. De ziekte genezen doen ook deze middelen namelijk niet. Dat komt onder meer doordat wetenschappers nog niet goed weten wat er precies gebeurt in het brein van mensen met alzheimer. Hoe komt dat? En welke oplossingen zijn er in de maak?
— Wiesje van der Flier, over de Alzheimermedicijnen uit de VS
Kenmerkend voor de ziekte van Alzheimer zijn de geheugenproblemen. Toch ziet de ziekte er van persoon tot persoon anders uit. Waar de een bijvoorbeeld steeds vergeet dat ze al boodschappen heeft gedaan, weet de ander niet meer waar een afstandsbediening voor dient. Dat komt doordat hersencellen niet goed meer met elkaar kunnen praten.
Eiwitklonten
Bij mensen met alzheimer ontstaan klonten van het eiwit amyloïde tussen cellen in het brein. De klonters vormen vreemde uitsteeksels die giftig zijn voor hersencellen. Daardoor zijn deze cellen niet meer goed in staat boodschappen aan elkaar door te geven. Vervolgens ontstaan kluwens van het eiwit tau in de hersencellen, die de interne communicatie van de cel ontregelen. Zo kunnen de hersencellen steeds minder goed met elkaar communiceren. Op termijn sterven ze af, en ontstaan geheugenproblemen en uiteindelijk dementie. De oplossing lijkt simpel: ruim amyloïde en tau op en weg zijn de communicatieproblemen tussen cellen.
Dat blijkt iets te vroeg gejuicht. De geneesmiddelen die in de VS op de markt zijn, vegen inderdaad de hersenen schoon van amyloïdeklonten, ook wel ‘plaques’ genaamd, waardoor ook de hoeveelheid tau afneemt. Mensen met lichte dementieverschijnselen die deze middelen krijgen, gaan gemiddeld dertig procent minder hard achteruit op tests die onder meer geheugen en denkvermogen meten. Of patiënten dat duidelijk merken, is de vraag.
“Een veelbelovend resultaat, maar we zijn er nog niet. Zo lukt het nog niet om de achteruitgang tot staan te brengen”, zegt Wiesje van der Flier, hoogleraar en wetenschappelijk directeur van Alzheimercentrum Amsterdam van Amsterdam UMC. Bovendien is het niet duidelijk of de vertraging tijdelijk is. Het onderzoek duurde maar 18 maanden, terwijl het ziekteproces gemakkelijk 15 jaar duurt.
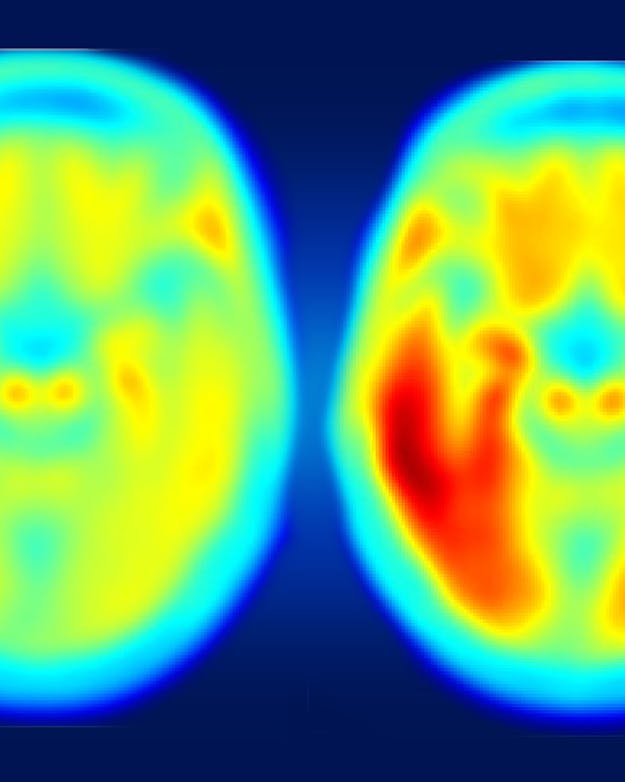
Hoe roder de kleur, hoe meer tau-eiwit in de hersenen. Links het gemiddelde brein van iemand die cognitief gezond is, waar ook wat tau is opgehoopt. In mensen met milde symptomen van de ziekte van Alzheimer (rechts) is er veel meer samenklontering van tau. Er is een verband tussen de hoeveelheid tau en de ernst van cognitieve problemen.
Matthew R. BrierDat schoonvegen maar een deel van de oplossing lijkt, komt vermoedelijk doordat amyloïde en tau het resultaat zijn van iets anders dat misgaat in hersencellen. Wat dat precies is, is niet helemaal duidelijk. Maar zoals er meerdere wegen naar Rome leiden, zijn er vermoedelijk ook meerdere wegen die naar de samenklontering van amyloïde kunnen leiden – en vervolgens tot dementie. Het goede nieuws is: er zijn wel wat richtingaanwijzers, en die zijn te vinden in de machinerie van de cel: eiwitten.
Haperende fabrieken
Eiwitten zijn de regelneven van de cel: ze geven bijvoorbeeld boodschappen door en vergemakkelijken zo de communicatie met andere cellen. Ze zijn met duizenden, en werken allemaal in de fabriek die de cel is. Wat er precies in die fabriek gebeurt, is moeilijk te meten, volgens hersenwetenschapper Betty Tijms van Alzheimercentrum Amsterdam, Amsterdam UMC. “Je kunt immers niet zomaar in de hersenen van levende mensen kijken.”
Toch slaagden zij en haar collega’s er eerder dit jaar in enig zicht te krijgen op de machinerie van de haperende hersencel bij mensen met alzheimer. En dat is nieuw. Met een hele dunne naald namen ze via de rug een beetje hersenvocht af bij mensen die al wat amyloïdestapeling hadden; een veelgebruikte maat voor lichte alzheimerverschijnselen. In dat hersenvocht bevinden zich duizenden eiwitten, waaronder amyloïde en tau. Tot voor kort konden wetenschappers al die andere eiwitten niet nauwkeurig meten, maar met steeds gevoeliger labapparatuur kan dat nu wel.
De onderzoekers lieten vervolgens de computer rekenen. Die ontdekte patronen in welke eiwitten vaak samen voorkomen bij mensen met beginnende alzheimer. De rekenmodellen vonden vijf subtypes. Bij ieder van die subtypes voltrekken zich verschillende scenario’s in de hersenen. Bij een van de subtypen reageren de microglia bijvoorbeeld heel heftig. Microglia zijn afweercellen die voortdurend in de gaten houden of er ergens schade is aan cellen, of dat er mislukte eiwitten rondzwerven. Vinden ze gekke dingen, dan maken ze de boel schoon. Maar in dit scenario werken de microglia zo hard dat ze overstuur raken. Dan ontstaan ontstekingen in de hersenen. Bij een ander subtype worden de microglia zelf niet lekker en staken ze juist hun schoonmaakwerk.
Gerichte medicijnen
Dankzij dit soort inzichten is er voor het eerst zicht op geneesmiddelen die precies het fabrieksproces aanpakken op de plek waar het misgaat, volgens Van der Flier. In het ideale geval wil je kunnen testen wie welk subtype heeft, en daar vervolgens een medicijn bij vinden. “Als je weet dat de stakende microglia het probleem zijn, kun je die met een medicijn een zetje geven om ze weer aan het werk te krijgen. Bij de overactieve microglia wil je dat juist niet”, legt Tijms uit.
Er zijn al medicijnen die bijvoorbeeld de microglia aanpakken, maar dat zat niet in het onderzoek van Tijms en collega’s. Hun doel was vooral te bestuderen óf ze verschillende eiwitpatronen konden meten. Het bepalen van welke medicijnen bij welke subtypes zouden passen, is een volgende stap.
Overigens blijkt testen op subtype nog niet zo eenvoudig: de onderzoekers deden er 3 maanden over om in het hersenvocht van 609 mensen 3863 eiwitten te meten. Daarna moest de computer nog gaan rekenen om de belangrijkste 1058 eiwitten eruit te vissen. Die hele riedel moet sneller kunnen om bruikbaar te zijn voor artsen. Daarom willen Tijms en collega’s bekijken of een kleiner aantal eiwitten meten ook voldoende is om subtypes van elkaar te kunnen onderscheiden – als een soort ‘handtekening’. En dan het liefst in bloed, want dat is een stuk eenvoudiger af te nemen, en veel prettiger voor de patiënt.
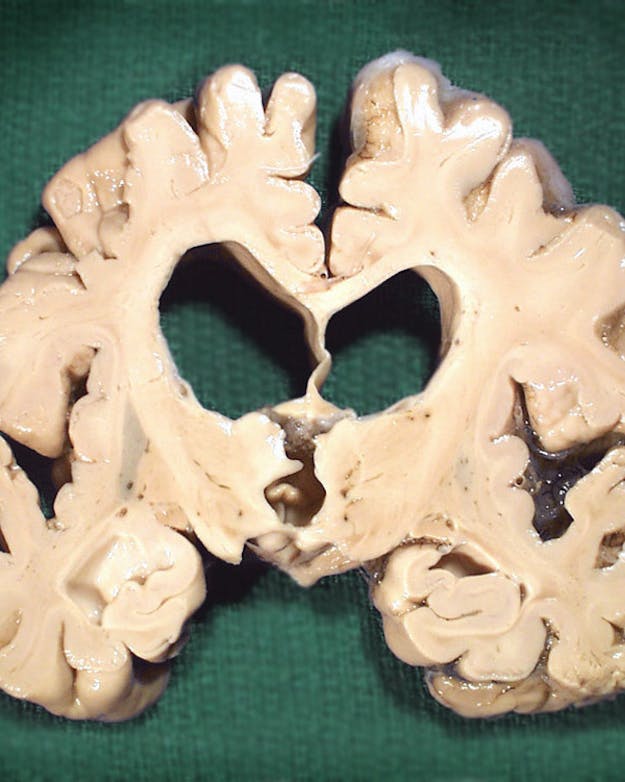
In de hersenen van patiënten met de ziekte van Alzheimer vallen letterlijk gaten, omdat zenuwcellen door de samenklontering van eiwitten kapot gaan.
Flickr, AJC1 via CC BY-NC 2.0Die belasting is trouwens ook een punt van aandacht voor de nieuwe medicijnen: patiënten moeten regelmatig voor een infuus naar het ziekenhuis. Als ze dan ook niet in staat blijken de ziekte van Alzheimer tot staan te brengen betekent dat dan dat we ze maar moeten afschrijven? Nee hoor, vindt Van der Flier. De medicijnen vormen het startschot voor de zoektocht naar gerichtere medicijnen. Het is namelijk ook mogelijk dat een gunstig effect bij het ene deel van de groep onderzoeksdeelnemers een ongunstig effect bij een ander deel van de groep verhult. Van der Flier: “Helaas kunnen we nu nog niet van tevoren voorspellen bij wie het wel werkt en bij wie niet. Maar nu we meer zicht beginnen te krijgen op welke eiwitten ontregeld zijn, kunnen we wel beter begrijpen waarom medicijnen bij sommige mensen juist heel goed werken.”

